Класс
Продолжительность выполнения работы – 60 минут
Задание 1.
Составьте формулы всех изомеров, соответствующих составу С4Н8. Назовите их. (12 баллов)
Задание 2.
Осуществите превращения, составьте уравнения реакций в молекулярном виде:
CuSO4→FeSO4→Fe(OH)2→Fe(OH)3→FeCl3→CuCl2→Cu→Cu(NO3)2
(7 баллов)
Задание № 3.
Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + H2S + H2SO4→MnSO4 + S +…+…
Определите окислитель и восстановитель.
(7 баллов)
Задание 4.
К 182, 5 мл 20% - ого раствора соляной кислоты (ρ = 1,1 г/мл) прибавили 53г карбоната натрия. Определите массовые доли веществ в полученном растворе. (10 баллов)
Задание 5.
При прибавлении к раствору нитрата двухвалентного металла избытка карбоната калия выпадает 2,37г осадка, а при прибавлении к тому же количеству этого раствора избытка сульфата натрия – 2,80г осадка. Определите, нитрат какого металла был взят для анализа.
(8 баллов)
Всего за олимпиаду 44 балла
Инструкция по проверке олимпиадных заданий.
Всероссийская олимпиада школьников по химии
2012 – 2013 учебный год
1 (школьный этап)
10 класс
Продолжительность выполнения работы – 60 минут.
Задание 1.
Составьте формулы всех изомеров, соответствующих составу С4Н8. Назовите их.
| CH3 – CH2 – CH = CH2 бутен - 1 | 1 балл 1 балл |
СН3 – C = CH2
 CH3 метилбутен (2 – метилбутен)
CH3 метилбутен (2 – метилбутен)
| 1 балл 1 балл |
 циклобутан
циклобутан
| 1 балл 1 балл |

 СН3
метилциклопропан СН3
метилциклопропан
| 1 балл 1 балл |
Н Н
  С = С
С = С
  H3C CH3 цис – бутен - 2
H3C CH3 цис – бутен - 2
| 1 балл 1 балл |
H3C Н
  С = С
С = С
  H CH3 транс - бутен - 2
H CH3 транс - бутен - 2
| 1 балл 1 балл |
| Всего | 12 баллов |
Задание 2.
Осуществите превращения:
CuSO4→FeSO4→Fe(OH)2→Fe(OH)3→FeCl3→CuCl2→Cu→Cu(NO3)2
Решение: CuSO4+Fe 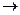 FeSO4+Cu
FeSO4+Cu
FeSO4+2NaOH 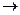 Fe(OH)2+Na2SO4
Fe(OH)2+Na2SO4
4Fe(OH)2+O2+2H2O 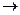 4Fe(OH)3
4Fe(OH)3
Fe(OH)3+3HCl 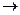 FeCl3+3H2O
FeCl3+3H2O
2FeCl3+Cu 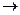 2FeCl2+CuCl2
2FeCl2+CuCl2
CuCl2+Zn 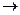 Cu+ZnCl2
Cu+ZnCl2
Cu+4HNO3 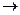 Cu(NO3)2+2NO2+2H2O
Cu(NO3)2+2NO2+2H2O
За каждую реакцию по 1 баллу. Всего 7 баллов.
Задание 3.
Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + H2S + H2SO4 → MnSO4 + S + …+…
Определите окислитель и восстановитель.
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла.) | Баллы |
| Элементы ответа: За определение веществ За определение степеней окисления Составлен электронный баланс: 2 │ Mn+7+ 5e → Mn+2 5 │ S-2 – 2e →S0 Расставлены коэффициенты в уравнении реакции: 2KMnO4+ 5H2S + 3H2SO4= 5S + 2 MnSO4+ K2SO4+ 8 H2O Указано, что Mn+7(KMnO4за счет Mn+7) – окислитель, процесс восстановления S-2(H2Sза счет S-2) – восстановитель, процесс окисления | 2 балла 1 балл 2 балла 1 балл 1 балл |
Всего: 7 баллов
Задание 4.
К 182, 5 мл 20% - ого раствора соляной кислоты (ρ = 1,1 г/мл) прибавили 53г карбоната натрия. Определите массовые доли веществ в полученном растворе.
 1моль 0,5 моль 1моль 0,5 моль
| |
 2HCl + Na2CO3 2NaCl + H2O + CO2 2HCl + Na2CO3 2NaCl + H2O + CO2
| 1 балл |
| 36,5 г/моль 106 г/моль 58,5 г/моль 18 г/моль 44 г/моль | |
| n(HCl)= (182,2 мл*0,2*1,1 г/мл): (36,5г/моль)=1,1моль | 2 балла |
n(Na2CO3)= 
| 1 балл |
| Na2CO3 – в недостатке | 1 балл |
| В растворе после реакции: 1 моль NaCl, 0,1 моль HCl | 1 балл |
| m (р-ра) = 182,5 моль·1,1 г/моль + 53г – 0,5 моль·44 г/моль = 200,75г+53г-22г=231,75г | 2 балла |
W (NaCl) =  = 0,2524 (25,24%) = 0,2524 (25,24%)
| 1 балл |
W (HCl) =  = 0,0157 (1,57%) = 0,0157 (1,57%)
| 1 балл |
| Всего | 10 баллов |
Задание 5.
При прибавлении к раствору нитрата двухвалентного металла избытка карбоната калия выпадает 2,37г осадка, а при прибавлении к тому же количеству этого раствора избытка сульфата натрия – 2,80г осадка. Определите, нитрат какого металла был взят для анализа.
 Me (NO3)2 + К2CO3 → MeCO3 + 2КNO3
(x + 60) г/моль Me (NO3)2 + К2CO3 → MeCO3 + 2КNO3
(x + 60) г/моль
| 1 балл 1 балл |
 Me (NO3)2 + Na2SO4 → MeSO4 + 2NaNO 3
(x + 96) г/моль Me (NO3)2 + Na2SO4 → MeSO4 + 2NaNO 3
(x + 96) г/моль
| 1 балл 1 балл |
| (х+60)/(x+96)=2.37/ 2.80 | 1 балл |
| 2,80x-2.37x=227-168 0.43x=59 | 1 балл |
| х=137 | 1 балл |
| Ва | 1 балл |
| Всего | 8 баллов |
Всего за олимпиаду 44 балла