Лабораторная работа № 1.
Цель работы: изучить реакции электрофильного присоединения, замещения и элиминирования, изучить реакции нуклеофильного замещения, присоединения, присоединения – элиминирования, радикального замещения с участием органических соединений, изучить окислительно - восстановительные свойства органических соединений.
Реактивы: раствор олеата натрия, бромная вода (разбавленная), р–р фенола, этанол, насыщенный раствор 2,4-динитрофенилгидразина, формалин, ацетон, насыщенный раствор гидросульфита натрия; 10 %-ный раствор гидроксида натрия, хромовая смесь, 5 %-ный раствор сульфата меди (II)
Опыт1. Биологически важные реакции электрофильного присоединения, электрофильного замещения и элиминирования
Опыт 1.1. Бромирование непредельных соединений.
В одну пробирку помещают 1 мл водного раствора олеата натрия, в другую – такой же объем дистиллированной воды. В каждую пробирку добавляют по 2 капли водного раствора брома (бромная вода). Сравнивают окраску содержимого пробирок.
Уравнение реакции:
СН3(СН2)7СН=СН(СН2)7СОONa + Br2 ® СН3(СН2)7СНBr-CHBr(СН2)7СОONa
натриевая соль олеиновой к-ты натриевая соль 9,10- дибромстеариновой к-ты
Опыт 1.2. Бромирование ароматических соединений. Образование триброманилина.
В пробирку помещают 1 мл р – ра фенола, прибавляют по каплям бромную воду. Наблюдают обесцвечивание бромной воды.
Уравнение реакции:
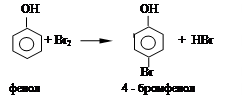 |
Опыт 2. Биологически важные реакции нуклеофильного замещения, нуклеофильного присоединения, нуклеофильного присоединения – элиминирования, радикального замещения
Опыт 2.1. Взаимодействие формальдегида с 2,4- динитрофенилгидразином.
В пробирку помещают 0,5 мл насыщенного раствора 2,4- динитрофенилгидразина, добавляют 5 - 10 капель формалина. Наблюдают появление желтого осадка.
Уравнение реакции:
 |
Опыт 2.2. Присоединение гидросульфита натрия к ацетону.
На предметное стекло помещают 1 каплю насыщенного раствора гидросульфита натрия и добавляют 1 каплю ацетона. Рассматривают форму образовавшихся кристаллов.
Уравнение реакции:

Опыт 3. Окислительно - восстановительные свойства веществ.
Опыт 3.1. Окисление спиртов.
В пробирку наливают 2 - 3 мл хромовой смеси и добавляют по каплям при встряхивании 0,5 мл этилового спирта. Наблюдают изменение цвета и температуры реакционной массы. Одновременно ощущается запах уксусного альдегида, напоминающий запах зеленого яблока (нюхать осторожно!).
Уравнение реакции
3С2Н5ОН + K2Cr2O7 + 4H2SO4 ® 3СН3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Опыт 3.2. Окисление альдегидов.
В две пробирки наливают по 10 капель 10 %-ного раствора гидроксида натрия, добавляют 5 капель раствора сульфата меди. К образовавшемуся голубому осадку гидроксида меди (II) добавляют: в первую пробирку – 10 капель раствора формальдегида, во вторую – 10 капель ацетона. Пробирки осторожно нагревают до кипения. Отмечают наблюдаемые изменения.
Уравнения реакций:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
HCНО + 2Cu(OH)2↓  HCООН + 2CuOH↓ + H2O
HCООН + 2CuOH↓ + H2O
голубой желтый
2СuOH  Cu2O↓ + H2O,
Cu2O↓ + H2O,
красный
Сu(OH)2  CuO↓ + H2O
CuO↓ + H2O
черный
СН3 – СО – СН3 + 2Cu(OH)2↓ 
Контрольные вопросы
1. Дайте определение понятия «электрофил». В реакциях какого типа могут принимать участие электрофильные частицы?
2. Приведите общую схему процесса электрофильного присоединения к ненасыщенным соединениям.
3. Лекарственный препарат «Линетол», получаемый из льняного масла, содержит смесь эфиров олеиновой, линолевой и линоленовой кислот. Произойдёт ли обесцвечивание бромной воды при её взаимодействии с водным раствором этого препарата? Ответ поясните.
4. Дайте определение понятия «нуклеофил». Приведите схемы бимолекулярного и мономолекулярного механизмов нуклеофильного замещения.
5. Напишите реакцию гидролиза этилацетата в щелочной среде. Является ли этот процесс необратимым?
6. Можно ли использовать реакцию с фенилгидразином для выделения альдегидов и кетонов из трудно разделяемых смесей?
7. По какому механизму протекает галогенирование алканов? Какие жизненно важные процессы в организме протекают по такому же механизму?
8. Сравните лёгкость окисления первичных, вторичных и третичных спиртов.
9. Какие карбонильные соединения окисляются в более мягких условиях: альдегиды или кетоны?
10. Можно ли отнести карбоновые кислоты к веществам, устойчивым к окислению? Какие карбоновые кислоты относительно легко вступают в реакции с окислителями?
11. В животных организмах одноосновные карбоновые кислоты окисляются, причем атом кислорода направляется всегда в одно и то же положение. В какое именно? В какую кислоту превращается масляная кислота в организме больных диабетом?
12. Соединения какого типа выступают в живых организмах в качестве ингибиторов окислительных процессов?