Электронная конфигурация атома – показывает распределение ē по энерг. уровням и подуровням.
+1Н
1s1 ←число ē с данной формой облака
↑ ↖ форма электронного облака
Номер
энерг.уровня
Графические электронные формулы (изображения электронной структуры атома) –
показывает распределение ē по энерг. уровням, подуровням и орбиталям.
I период: +1Н
Где ↑ - ē, ↑↓ - ē с антипараллельными спинами, орбиталь.
При записи графической электронной формулы следует помнить правило Паули и правило Хундда «Если в пределах одного подуровня имеется несколько свободных орбиталей, то ē размещаются каждый на отдельной орбитали и лишь при отсутствии свободных орбиталей объединяются в пары».
(Работа с электронными и графическими электронными формулами).
Напр., H+11s1; He+21s2; Li+31s22s1; Na+11 1s2 2s2 2p63s1; Ar+181s2 2s2 2p6 3s23p6;
I период: водород и гелий – s-элементы, у них заполняется электронами s-орбиталь.
II период: Li и Be – s-элементы
B, С, N, O, F, Ne – р-элементы
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на 4 электронных семейства или блока:
1) s-элементы – у них заполняется ē-ми s-подуровень внешнего слоя атома; к ним относятся водород, гелий и эл-ты гл.п/гр. I и IIгрупп.
2) р-элементы – у них заполняется электронамир-подуровень внешнего уровня атома; к ним относят элементы гл.п/гр. III - VIIIгрупп.
3) d-элементы – у них заполняется электронами d-подуровень предвнешнего уровня атома; к ним относятся эл-ты побоч.п/гр.. I- VIII групп,т.е. эл-ты вставных декад больших периодов, распложенные между s- и р-элементами, их также называют переходными элементами.
4) f-элементы - у них заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды (4f-элементы) и актиноиды (5f-элементы).
У атомов меди и хрома происходит «провал» ē с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
29Cu 1s22s22p63s23p6 4s13d10 24Cr 1s22s22p63s23p6 4s13d5
Экспериментально доказано, что состояния атомов, при которых p-, d-, f-орбитали заполнены наполовину (p3, d5, f7), целиком (p6, d10, f14) или свободны, обладают повышенной устойчивостью. Этим объясняются переходы – «провалы» - электронов между близкорасположенными орбиталями. Те же отклонения наблюдаются у аналога хрома – молибдена, а также у элементов подгруппы меди – серебра и золота. Уникален в этом отношении палладий, у атома которого 5s-электронывообще отсутствуют и который имеет след. Конфигурацию: 46Pd 1s22s22p63s23p64s23d104р65s04d10.
Вопросы для самоконтроля
1. Что такое электронное облако?
2. Чем отличается 1s-орбиталь от 2s-орбитали?
3. Что такое главное квантовое число? Как оно соотносится с номером периода?
4. Что такое подуровень и как это понятие соотносится с номером периода?
5. Составить электронные конфигурации атомов элементов 4-6 периода ПСХЭ.
6. Составить электронную конфигурацию атомов магния и неона.
7. Определить какому атому принадлежит электронная конфигурация 1S22S22p63S1, 1S22S22p63S2, 1S22S22p4, 1S22S1
ПЛАН ЗАНЯТИЯ № 7
Дисциплина: Химия.
Тема: Ионная и ковалентная химическая связь.
Цель занятия: Изучить механизмы образования ионной и ковалентной связи, рассмотреть ионные, атомные и молекулярные кристаллические решетки.
Планируемые результаты
Предметные: владение основополагающими химическими понятиями: химическая связь, ионы, кристаллические решетки, уверенное пользование химической терминологией и символикой; сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций: составление электронных конфигураций атомов химических элементов.
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
2. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
3. Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
4. Механизм образования ковалентной связи (обменный и донорно-акцепторный).
5. Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
6. Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
Оснащение: Модели кристаллических решеток, учебник, периодическая система химических элементов Д.И.Менделеева.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 7. Ионная и ковалентная химическая связь.
План:
1) Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
2) Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
3) Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
4) Механизм образования ковалентной связи (обменный и донорно-акцепторный).
5) Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
6) Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
Химическая связь - это взаимодействие атомов, обусловливающее устойчивость химической частицы или кристалла как целого. Химическая связь образуется за счет электростатического взаимодействия между заряженными частицами: катионами и анионами, ядрами и электронами. При сближении атомов начинают действовать силы притяжения между ядром одного атома и электронами другого, а также силы отталкивания между ядрами и между электронами. На некотором расстоянии эти силы уравновешивают друг друга, и образуется устойчивая химическая частица.
При образовании химической связи может произойти существенное перераспределение электронной плотности атомов в соединении по сравнению со свободными атомами. В предельном случае это приводит к образованию заряженных частиц - ионов (от греческого "ион" - идущий).
Взаимодействие ионов:
Если атом теряет один или несколько электронов, то он превращается в положительный ион - катион (в переводе с греческого - "идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
Рассмотрим возникновение ионной связи, например, между атомами натрия и атомами хлора в хлориде натрия NaCl.
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона – катиона натрия Na+.
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона – аниона хлора Cl-.
Между образовавшимися ионами Na+ и Cl-, имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение – хлорид натрия с ионным типом химической связи.
Ионная связь – это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев.
1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:

где n — число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в отрицательные ионы:

3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.

2. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
Классификация ионов:
1. По знаку заряда: катионы (положительные, K+, Ca2+, H+) и анионы (отрицательные, S2-, Cl-, I-).
2. По составу: сложные ( ,
, 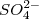 ) и простые (Na+, F-)
) и простые (Na+, F-)