На основе имеющихся научных исследований были сформулированы методы подавления образования “термических” NO путем снижения скорости реакции их образования:
· снижение общего уровня температур в топке путем рециркуляции продуктов сгорания с Т<400 C, подачи пара и воды в зону горения и в дутьевой воздух;
· снижение максимальных локальных температур в топке путём усиленной подачи газов рециркуляции, пара и воды в зоны максимальных температур (впрыск воды, пара в отдельные зоны факела, подача газов рециркуляции по оси, усиленная подача газов рециркуляции в центральные горелки);
· уменьшение максимальной температуры и содержания кислорода в зоне максимальных температур путем организации ступенчатого горения;
· уменьшение общего избытка окислителя в пределах, допустимых по условиям начала быстрого увеличения выхода продуктов неполного горения С, СО, С20Н12.
Методы определения скорости горения пиросоставов базируются на фиксации временя начала и конца горения столбика состава определенной длины. Эта фиксация осуществляется визуально (при атмосферном давлении), при помощи термопар, фоторегистра или кинокамеры.
Существует два способа для количественной характеристики скорости горения: линейной скорости и в мм/с и массовой скорости ит, выражаемой в размерности г/см2-с; последняя показывает количество состава, сгорающее в 1 секунду единицы горящей поверхности. Массовую скорость горения можно вычислить по формуле Um = 0,1 u*d где d— плотность состава в г/см3.
Как было уже указано, горение протекает равномерно лишь при достаточном уплотнении состава. Для оценки степени уплотнения 'необходимо определить коэффициент уплотнения /С, представляющий собой частное от деления практически достигнутой плотности d на предельную плотность состава dmax последняя находится вычислением исходя из плотности компонентов состава:
K=d/dmax
dmax = ..............100...................
...............a/d1 + b/d2 +... n/dn
где di, d1 d2,..., dn, — плотность компонентов;
а, Ь,..., п — содержание этих компонентов в составе в %.
Для большинства спрессованных составов коэффициент уплотнения колеблется в пределах 0,7—0,9. Насыпная плотность порошкообразных составов составляет 40—60% от dmax.
Для различных составов линейная скорость горения колеблется весьма значительно: от десятых долей мм/с (для дымовых составов) до 20—30 мм/с (для быстрогорящих осветительных составов).
От каких же факторов зависит скорость горения сосгавов?
Скорость сложнейшего физико-химического процесса — горения — определяется скоростью отдельных (элементарных) химических реакций и процессами диффузии и теплопередачи из одной зоны реакции в другую.
Интенсивность теплопередачи в значительной мере определяется разностью температур в различных зонах реакции. Составы, имеющие наиболее высокую температуру пламени, являются, как правило, и наиболее быстро горящими.
Однако существующие исключения из этого правила показывают, что высокая температура в пламени является только одним из факторов, определяющих скорость горения составов.
1 Пористость состава будет характеризоваться значением (\—К). Следовательно, пористость спрессованных составов лежит в пределах 0,3—0,1.
Скорость горения в большой степени зависит от наличия в составе низкоплавящихся или легколетучих компонентов. При наличии их то тепло, которое пр:и других условиях вызвало бы резкое повышение температуры в зоне реакции, расходуется на плавление или испарение этих веществ.
Именно этим в значительной мере объясняется тот факт, что низкоплавящиеся органические вещества (смолы, парафин, стеарин и др.) при введении их в двойные смеси (окислитель — мегалл) резко уменьшают скорость горения.
Ведущими в процессе горения являются высокоэкзотермические (пламенные) реакции.
Однако скорость многостадийного процесса горения в целом определяется прежде всего тем, с какой скоростью протекает наиболее трудно и медленно идущая стадия процесса; такими являются эндотермические химические процессы.
Во многих случаях скорость горения составов определяется скоростью процесса разложения окислителя.
Объективным показателем, характеризующим легкость разложения окислителя, может служить парциальное давление над ним кислорода при различных температурах.
Как известно, константа скорости химической реакции К, чрезвычайно сильно возрастает при повышении температуры по закону
.........-E/RT
K=Be
где ^ В— предэкслоненциалыный множитель;
Е— энергия активации в ккал/г-моль (кДж/г-моль);
R — газовая постоянная.
Но знание максимальной температуры и энергии активации процесса не дает нам реальной возможности вычисления скорости горения, так как горение — это совокупность химических реакций, протекающих в неизотермических условиях.
Безусловно, очень важно знание промежуточных стадий процесса горения. Но для 'выяснения их требуется проведение весьма сложного эксперимента; в настоящее время данные эти для большинства пиросоставов, к сожалению, отсутствуют.
Переходя к рассмотрению фактического материала, следует указать, что скорость горения составов определяется как их рецептом (химические факторы), так и условиями горения (физические факторы).
Под химическими факторами понимается влияние:
1) индивидуальных свойств компонентов состава;
2) количественного соотношения между ними;
3) ускоряющего действия каталитических добавок. Из рассмотрения данных о скорости горения сильно уплотненных составов при атмосферном давлении и 20° С следует, что наиболее быстрогорящими являются двойные смеси нитратов щелочных (или щелочноземельных) металлов с магнием, содержащие в себе 40—65% магния. Еще быстрее горят составы с цирконием.
Составы с алюминием при условии одинакового измельчения металла горят значительно медленнее, чем составы с магнием 1. Одна из причин — большая разница в температуре кипения магния и алюминия: 1100 и ~2300° соответственно. Медленно горят составы, содержащие в качестве основного горючего бериллий, бор или кремший. Чем выше температура воспламенения горючего, тем меньше при прочих равных условиях скорость горения состава. Возможно, имеется также взаимосвязь между скоростью горения состава я числом Пиллинга и Бэдворса для содержащегося в составах металла,,(а также В и Si). Для быст-рогорящих металлов, Mg,и Zr эти числа соответственно равны 0,81 и 1,45; для Be, Si и В эти числа больше и равны соответствeнно 1,75; 2,04 и 4,08.
При практическом использовании смесей, содержащих алюминий, происходит неполное его сгорание. Горение капель алюминия в газовом потоке изучалось многими авторами [158]. Большое внимание было уделено процессу горения тройной системы:
МН4СlO4+ органическое горючее+А1.
А. Ф. Беляев [10] делает следующие выводы:
1. Увеличение концентрации алюминиевого порошка (в тройной смеси, прим. авт. данной книги)приводит к увеличению времени горения его частиц.
2. Увеличение времени горения происходит за счет ухудшения газового состава окисляющей среды и в результате агломерации (курсив автора), которая приводит к укрупнению горящих частиц алюминия.
3. Агломераты, помимо алюминия, содержат значительное количество продуктов частичного разложения органического горючего. Время горения агломератов зависит от количества содержащегося в них алюминия».
Находящиеся в газовом потоке (в дымогазовой зоне пламени) капли алюминия покрыты слоем оксидной пленки и доступ газа-окислителя к еще не окисленному металлу затруднен. Нарушение оксидной пленки на капле металла может быть вызвано:
1) плавлением Аl2О3 (при 2030° С);
2) пробиванием ее изнутри парями металла при температуре, близкой к температуре его кипения (~2300°С). Следовательно, горение капель алюминия протекает весьма интенсивно в том случае, когда температура пламени превышает 2200—2300° С.
Опубликована работа [73] о взаимосвязи между химическим строением органических горючих и скоростью горения стехиомет-
* Один из возможных способов активизации горения частиц алюминия — покрытие их магниевой пленкой.
рических двойных смесей (NH4C104+ органическое вещество) при 20 атмосферах. Было изучено 25 различных твердых органических веществ.
Медленнее всех горели смеси с органическими кислотами — 3,0 мм/с, быстрее — смеси со спиртами и углеводородами, 4,5— 4,8 мм/с, еще быстрее смеси с аминами и нитросоединениями, 5,4—6,0 мм/с, затем смеси с нитраминами — 7,0 мм/с; смесь с ферроценом горела значительно быстрее всех других — 15 мм/с.
Авторы работы пришли к выводу, что в данном случае скорость горения не зависит от калорийности смесей, а определяется прочностью слабейшей связи в молекуле горючего; прочность связи уменьшается до ряду С—С, С—NH2, С— NОз, N—NO2. Большую скорость горения смеси с ферроцаном (C5H5)2Fe авторы объясняют каталитическим действием образующейся в результате горения окиси железа.
По вопросу о зависимости максимальной скорости горения от соотношения компонентов в смеси высказываются следующие соображения.
Составы делятся на две группы, в первой из которых максимум скорости горения лежит вблизи стехиометрического соотношения между компонентами (K='0,7/0,9), а для второй группы резко сдвинут в сторону избытка горючего (вплоть до K1 < O,1).
К первой группе относятся составы, в которых основным горючим является органическое связующее, а порошок металла играет лишь роль добавки.
Ко второй группе относятся составы, где основным горючим является порошок металла, а органическое связующее используется лишь как добавка, улучшающая механические свойства заряда.
В соответствии с этим скорость горения двойных смесей окислитель — металл быстро возрастает с увеличением содержания в составе металлического горючего (конечно, до известного предела; для магния этот предел равен 60—70%). Это в известной мере связано с повышением теплопроводности состава при увеличении в нем содержания металла.
Циркониевые составы устойчиво горят при содержании циркония до 80%.
По данным А. Ф. Беляева, двойные смеси КС104—W устойчиво горят при содержании вольфрама до 90—95%. Надо думать, что значение предельного содержания металла, при котором смеси еще.способны,к горению, определяется не только термохимией процесса или легкостью окисления металла, но и его плотностью; она увеличивается по ряду Mg— >Zr— >-W. При горении составов, содержащих сплав А1—Mg, наблюдается своеобразное явление: сначала из частичек сплава испаряется и в парах сгорает магний и лишь позднее сгорает алюминий.
* К — обеспеченность состава окислителем.
При одинаковом содержании металла двойные смеси NaNO3 с магнием горят быстрее, чем смеси NaClO3 с магнием. Возможно, причиной этого является экзотермическое взаимодействие расплава нитрата с магнием в конденсированной фазе. Значительную роль здесь играет также то обстоятельство, что газовая
Таблица 8.1
| Скорость | |
| горения | |
| при атмос | |
| Назначение составов | ферном |
| давлении и | |
| К > 0,85, | |
| мм/с | |
| Осветительные и трас | |
| сирующие | 1—10 |
| Сигнальных огней | 1—5 |
| Термитно - зажига | |
| тельные.... | 1—3 |
| Дымовые.... | 0,5—2 |
среда в случае нитратов будет состоять из смеси оксидов азота и кислорода, а в случае хлоратов — только из кислорода.
Из смесей, не содержащих в себе металлических горючих, быстро горят многие хлоратные смеси и дымный порох. В работах А. Ф. Беляева рассматривается влияние серы на скорость горения дымного пороха [11];
имеется также работа Бентура и др. о влиянии на скорость горения пороха различных органических добавок.
Среднюю скорость горения имеют смеси нитр.ата калия с древесным углем или идитолом.
Данные о скорости горения различных видов составов приведены в табл. 8.1.
Составы с нитратами, не содержащие порошков металлов, горят в большинстве случаев медленно и малоинтенсивно.
Скорость горения некоторых хлоратных и нитратных смесей показана в табл. 8.2.
^ Таблица 8.2 Скорость горения стехиометрических двойных смесей в мм/с
| Горючее | Окислитель | |||
| КСlO3 | KNO3 | NaNO3 | Ва (N03)2 | |
| Сера...... | 2 6 2,5 | Не горит 2 1 | Не горит 1 0,5 | ---- 0,3 0,1 |
| Древесный уголь Сахар..... | ||||
Примечание. К •=0,5 16 мм/0,6; смеси cжиuгались в картонных трубках диаметром 16 mm
Введение олифы или канифоли в многокомпонентные составы сильно замедляет процесс их горения.
Как видно из табл. 8.2, смеои хлората с серой горят довольно энергично; смеси же нитратов натрия или калия с серой зажигаются с большим трудом и горение их малоустойчиво. Это объясняется тем, что количество тепла, выделяющееся при горении серы, недостаточно для того, чтобы вызвать разложение нитрата и 0'беспечить прогревание соседних слоев состава.
Легче зажечь составы, содержащие избыток серы и малый процент нитрата натрия (17%); большая часть серы при этом сгорает за счет кислорода воздуха; такие составы нашли применение в народном хозяйстве (см. гл. XXI).
^ Каталитические добавки
До сего времени не разрешена полностью проблема катализа при горении пиротехнических составов. Имеются работы по исследованию влияния различных каталитических добавок на скорость горорения модельных составов ракетного топлива с окислителем — перхлоратом аммония. Известно, что добавка ферроцена во многих случаях ускоряет процесс горения. Выяснено, что при прочих равных условиях ускоряющее действие катализаторов будет тем больше, чем медленнее протекает основной (некатализируемый) процесс горения. Следовательно, наибольшее действие катализаторы будут оказывать на горение низкотемпературных составов; при повышении давления влияние катализатора на скорость горения будет уменьшаться.
Имеются работы по осуществлению горения при атмосферном давлении NH4C104 и NH4NO3 с каталитическими добавками: для первого оказались наиболее эффективными соединения меди, для второго — хроматы и бихроматы щелочных металлов. Введение катализаторов в хлоратные составы увеличивает скорость горения двойных смесей КСlOз+идитол; хлоратные составы с малым процентом горючего (2—4%), не способные к горению, приобретают эту способность при добавлении катализатора (например, Мn02).
Присадка к алюминию небольшого количества кобальта (~1%) вызывает, по сообщению W. M. Fassel'a, резкое увеличение скорости горения частиц алюминия.
В пиротехнике для двойных смесей используются термины:
нижний и верхний концентрационные пределы, под которыми понимается то наименьшее и наибольшее содержание горючего (в вес. %), при которых смесь способна к горению. Очевидно, эти пределы зависят от внешнего давления и начальной температуры. Наличие катализатора во многих случаях способствуе снижению нижнего концентрационного предела, а также в некоторых случаях может способствовать повышению верхнего концентрационного предела.
^ Физические факторы
1. Плотность. Влияние плотности на скорость горения состава определяется тем, что с увеличением ее уменьшается возможность проникания горячих газов внутрь состава и тем самым замедляется процесс прогрева и воспламенения глубинных слоев. Особенно сильно сказывается влияние плотности на характере горения фотосмесей: 1 кг фотосмеси в порошкообразном состоянии сгорает в течение десятых долей секунды, а время сгорания такого же количества спрессованной фотосмеси выражается уже десятками секунд.
Большую роль в процессе горения играет газопроницаемость составов; определение газопроницаемости надлежало бы проводить и в условиях повышенной температуры, стремясь по возможности воссоздать реальные условия горения.
Для составов, не содержащих в себе металлического горючего и имеющих более низкую температуру пламени, скорость горения мало изменяется с изменением плотности состава.
Следует заметить, что существуют и такие малогазовые составы, увеличение плотности которых способствует передаче тепла в конденсированной фазе, я потому скорость горения их даже несколько увеличивается с увеличением плотности, установление зависимости скорости горения от плотности в значительной мере может способствовать выяснению вопроса о том, насколько большую роль при горении данного состава играют процессы, протекающие в конденсированной фазе.
2. Измельчение компонентов также в значительной мере влияет на скорость горения. Чем меньше размер частиц горючего, тем больше скорость горения.состава. Плоские частицы порошков металлов, имеющие при равном измельчении большую суммарную поверхность, чем каплеобразные, горят быстрее. Наиболее сильно влияет на скорость горения степень измельчения и форма частиц алюминия. Составы, изготовленные на А1-порошке, горят в несколько раз медленнее, чем составы, изготовленные на Al-пудре. Двумя важными факторами, влияющими на скорость горения пиротехнических составов, являются температура и давление.
3. Температура. С повышением начальной температуры составов скорость их горения увеличивается. Это понятно, так как при более высокой начальной температуре для протекания процесса горения требуется подача меньшего количества тепла из зоны пламени в конденсированную фазу.
Температурный коэффициент скорости горения тем меньше, чем выше температура пламени (температура горения) и чем выше давление, при котором происходит горение. Температурный коэффициент для одного и того же состава при неизменном давлении увеличивается при повышении начальной температуры состава.
Малое значение температурного коэффициента имеют смесевые пороха с окислителем — перхлоратом аммония.
' При повышении начальной температуры состава возрастает, хотя и неоднозначно, температура пламени.
По-видимому, меньший температурный коэффициент имеют вещества, или смеси, обладающие высокой температурой самовоспламенения.
Для вычисления температурного коэффициента а скорости горения используется формула
a=(1/u)* (du/dt)
Для индивидуальных ВВ а обычно лежит в пределах 3—8-10~3;
при изменении температуры на 1° С скорость их горения изменяется на 0,3—0,8%.
Температурный коэффициент скорости горения пиросоставов меньше, чем у ВВ или баллиститных порохов.
В интервале от —30° до +44° С для дымного пороха а равно 0,65-10~3. По нашим измерениям, для дымного пороха в интервале 0—100° С при атмосферном давлении
а =(1,5 ±0,4) -10-3.
Для исследованных в этом отношении пиросоставов а не превышает 3*10~3 (при температуре не выше 100° С). К. К. Андреев [4] дает температурный коэффициент как отношение u100* к uo*. Им приводятся значения температурного коэффициента для ряда ВВ и порохов, в том числе для нитроглицериновых порохов — 2,9 и для дымного пороха — 1,15.
Большинство измерений скорости горения пиросоставов - при повышенной температуре проводилось при t <150/200°.
Автором книги было осуществлено сжигание нагретых в электропечи до 850—900° С 40-мм шашек железоалюминиевого термита весом 220—240 г (плотность 2,8 г/см3).
Шашки горячего термита сгорели эа 5—6 с, вес шлака был 98—99% от первоначального веса состава; те же шашки при комнатной температуре зажечь не удалось. Теплая (нагретая до 100° С) шашка сгорела за 55 с.
Характер горения горячего и теплого термита мало отличались друг от друга. Увеличилась только, насколько можно было судить по визуальным наблюдениям, яркость свечения.
4. Давление. При большем давлении скорость реакции в газовой фазе больше, и зона высокой температуры придвигается ближе к поверхности конденсированной фазы. Соответственно возрастает и количество тепла, передаваемое в единицу времени из газовой в конденсированную фазу. Поэтому с увеличением внешнего давления скорость горения составов возрастает. Наоборот, в разреженном пространстве составы горят медленнее, чем при атмосферном давлении, а при значительном разрежении часто вообще теряют способность к распространению горения.
Как указывает К. К. Андреев, «существование минимального давления, ниже которого горение не распространяется, следует объяснить тем, что при уменьшении давления уменьшается скорость реакции в газовой фазе и соответственно количество подводимого к конденсированной фазе от газов тепла». Так как скорость теллоотвода по конденсированной фазе не зависит от давления, то при уменьшении последнего теплоприход становится меньше теплоотвода и горение затухает.
Быстрее других теряют способность к горению при понижении давления составы, содержащие большой избыток горючего или составы с трудноокисляемыми горючими.
Для порохов и ВВ зависимость u=f(p) часто выражается
формулой
и=А+Вр
где А, В и v — постоянные величины.
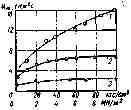
Рис. 8.2. Зависимость скорости горения стехиометрических нитратно-магниевых смесей от давления: 1-LiNОз; 2-NаNО3; 3-KNO3
Для ряда ВВ К. К. Андреев [84] на основании экспериментальных данных принимает v=l. А. Ф. Беляев указывает, что для большинства порохов и ВВ значение v лежит в пределах 0,5—1,0.
Для всех пиротехнических составов показатель степени v (в отличие от ВВ) будет значительно меньше единицы (рис. 8.2).
Известны случаи, когда зависимость u=f(p} с изменением давления существенно меняется, например, для пикрата калия или для дымного пороха. Исходя из этого попытки характеризовать зависимость скорости горения от давления, используя одни и те же значения В и v в широком диапазоне давлений не всегда приводят к правильным результатам.
Малая зависимость скорости горения от давления для какого-либо состава показывает, что в данном случае существенную роль играют экзотермические реакции, протекающие в конденсированной фазе.
Так, для трубочных порохов показатель v тем меньше, чем меньше объем газообразных продуктов горения V0 на 1 г пороха.
Казалось бы, что для безгазовых составов скорость горения не должна вообще зависеть от внешего давления. Но опытами А. Ф. Беляева с сотрудниками установлено, что скорость горения алюминиевых и магниевых термитов,все же несколько возрастает с повышением давления.
Так, для термитов Fе20з+А1, Мn02+А1 и Cr2O3+Mg при увеличении давления с 1 до 150 кгс/см2 (0,1—14,7 МН/м2) скорость горения увеличивается в 3—4 раза 1. Отсюда следует, что
' По данным работы, для флегматизированного добавкой Аl2Оз термита (Fе20з+2А]) скорость горения не зависит от давления.
при горении этих составов существуют реакции (возможно, реакция окисления алюминия кислородом, образовавшимся при распаде оксида железа), протекающие в газовой фазе или на поверхности раздела фаз. Детальное исследование зависимости скорости горения термита (Fе20з+А1) от давления и дисперсности компонентов имеется в работах. Вместе с тем, эксперимент Беляева показал, что существуют и составы, для которых скорость горения не зависит от давления: термит Сг20з+А1 горит с одинаковой скоростью (2,4 мм/с) как при 1 кгс/см2, так и при 100 иге/см2 (0,1—10 МН/м2). Из этого, по-видимому, следует сделать вывод, что в данном случае реакция горения от начала до конца протекает в конденсированной фазе.
5. Критический (минимальный) диаметр горения. Теплопотери при горении будут тем больше, чем меньше диаметр изделия (трубки). Исходя из этого для каждого состава существует критический диаметр, меньше которого при данных условиях (температура, давление, а также плотность состава) состав не способен к распространению горения.
Для быстрогорящих составов, выделяющих много тепла в единицу времени, критический диаметр весьма мал; так, черный порох (точнее пороховая мякоть) при р=\ кгс/м2 (9,8-Ю4 Н/м2), комнатной температуре в картонной оболочке имеет критический диаметр менее 1 мм.
Для многих магниевых и циркониевых составов значение dкрит выражается в единицах, а иногда и в десятых долях миллиметра.
Для медленногорящих дымовых составов dкрит порядка десятков миллиметров.
Значения dкрит для составов с необычными окислителями:
водой, органическими веществами, сульфатами металлов, имеются в работах [19], [29], [30].
Интенсивность теплообмена с окружающей средой также отражается на скорости горения составов. В узких трубках (малый диаметр изделия) она должна была бы быть несколько меньше, но в них затрудняется отток газов, создается избыточное давление, особенно в случае быстрогорящих составов, и потому практически уменьшение скорости горения не всегда наблюдается.
Величина минимального диаметра трубки, при котором еще возможно устойчивое горение, зависит от целого ряда факторов:
рецепта состава, начальной температуры, давления, материала и толщины стенок трубки и от плотности состава. Как правило, чем больше тепл.а выделяется при горении состава в единицу времени (т. е. чем быстрее горит состав), тем меньше для него значение минимального (критического) диаметра.
В связи с теплолотерями в окружающее пространство следует также рассматривать вопрос о минимально возможной скорости горения составов.
Осуществить при нормальных температуре и давлении процесс горения, имеющий очень малую скорость (например, 0,001 мм/с), невозможно, так как вследствие малого теплоприхода и относительно больших теплопотерь в окружающее пространство не удается создать той разности температур между газовой и конденсированной фазами, которая является одной из самых характерных черт процесса горения.
Одной из самых медленногорящих смесей является смесь из 96% МН4NОз и 4% древесного угля, горящая при атмосферном давлении и 20° С (с?=0,94 г/см3) со скоростью и=0,08 мм/с. Принимая приближенно объем газов, образующихся при горении, Уо=700 смз/г и температуру горения Г=900°К, получаем скорость течения газов в пламени:
u`=0.008*700* (900/293)=17 см/с.
Эта цифра близка к скорости горения самых медленногорящих газовых смесей. Я. Б. Зельдович указывает, что минимально возможная при нормальных условиях скорость горения газовой смеси CO+O2 должна составлять около 2 см/с.
При горении составов, дающих при сгорании большое количество газов, в замкнутом или полузамкнутом пространстве создается большое давление; скорость горения значительно возрастает, и горение может перейти во взрыв. Наиболее часто такое ускорение горения, заканчивающееся взрывом, наблюдается для хлоратных составов, содержащих большое количество (80—90%) хлоратов.