Тема 2a: «Металлы»
Задание 1: Составьте электронную формулу для указанного атома элемента. Укажите низшую и высшую его степень окисления. Приведите формулы оксидов и гидроксидов в характерных для данного элемента степенях окисления и укажите их характер.
| № варианта | Элемент |
| 1/16 | Fe |
| 2/17 | Co |
| 3/18 | Ni |
| 4/19 | Cr |
| 5/20 | V |
| 6/21 | Zn |
| 7/22 | Cu |
| 8/23 | Al |
| 9/24 | Sn |
| 10/25 | Pb |
| 11/26 | Ti |
| 12/27 | Zr |
| 13/28 | Cd |
| 14/29 | Mn |
| 15/30 | W |
Задание 2: Осуществите превращения. Составьте молекулярные и ионные уравнения.
1. Ni(OH)2 ® (NiOH)2SO4 ® NiSO4 ® Ni(OH)2
2. CuSO4 ® (CuOH)2SO4 ® Cu(OH)2 ® CuOHNO3
3. Bi(NO3)3 ® BiOH(NO3)2 ® Bi(OH)3 ® Bi2O3
4. Co(OH)2 ® CoOHCl ® CoCl2 ® Co(NO3)2
5. Pb(NO3)2 ® PbOHNO3 ® Pb(OH)2 ® K2PbO2
6. NiCl2 ® Ni(OH)2 ®NiOHCl ® NiCl2
7. CrOHCl2 ® CrCl3 ® Cr(OH)3 ® CrOHSO4
8. (SnOH)2SO4 ® SnSO4 ® Sn(OH)2 ® Na2SnO2
9. NiBr2 ® NiOHBr ®Ni(OH)2 ® NiSO4
10. CoSO4 ® Co(OH)2 ® (CoOH)2SO4 ® Co(NO3)2
11. [Cr(OH)2]2SO4 ® CrOHSO4 ® Cr2(SO4)3 ® CrCl3
12. NiSO4 ® (NiOH)2SO4 ® Ni(OH)2 ® NiBr2
13. FeOHSO4 ® Fe2(SO4)3 ® Fe(OH)3 ® FeCl3
14. NiBr2 ® Ni(OH)2 ® NiOHCl ® NiCl2
15. Al(OH)3 ® Al(OH)2Cl ® AlCl3 ® Al(NO3)3
16. Sn(OH)2 ® SnOHCl ® K2SnO2 ® Sn(OH)2
17. CoCl2 ® Co(OH)2 ® (CuOH)2SO4 ® CoSO4
18. Bi(OH)3 ® Bi(OH)2NO3 ® Bi(OH)3 ® Bi2O3
19. Cu(OH)2 ® CuOHCl ® CuCl2 ® Cu(NO3)2
20. CoSO4 ® (CoOH)2SO4 ® Co(OH)2 ® Co(NO3)2
21. Ni(NO3)2 ® NiOHNO3 ® Ni(OH)2 ® (NiOH)2SO4
22. Bi(OH)2NO3 ® Bi(NO3)3 ® Bi(OH)3 ® Bi(NO3)3
23. Cr2(SO4)3 ® CrOHSO4 ® Cr(OH)3 ® K3CrO3
24. SnCl2 ® SnOHCl ® Na2SnO2 ® Sn(OH)2
25. Pb(NO3)2 ® Pb(OH)NO3 ® Pb(OH)2 ® K2PbO2
26. Na2CO3 ® NaHCO3 ® H2CO3 ® K2CO3
27. AlCl3 ® Al(OH)3 ® Al(OH)2Cl ® Al(NO3)3
28. MgO ® Mg(NO3)2 ® Mg(OH)2 ® MgCl2
29. Na2S ® NaHS ® Na2S ® H2S
30. H2SO3 ® KHSO3 ® K2SO3 ® H2SO3
Задание 3: Напишите уравнения реакций (по две для каждого варианта) и составьте к ним электронно-ионные схемы. Для реакций металлов с H2SO4 концентрированной и HNO3 значение потенциала окислителя примите равным более 1 В. Оцените практическую устойчивость металлов в данной среде.
| 1. Al + HCl H2SO4конц. + Сu | 16. Sn + H2O + O2 H2SO4конц. + Bi |
| 2. Al + H2O + O2 H2SO4конц. + Sn | 17. Co + NaOH + H2O + O2 H2SO4конц. + Co |
| 3.Al + H2O H2SO4конц. + Zn | 18. Sn + NaOH + H2O + O2 H2SO4конц. + Be |
| 4.Al + KOH + H2O HNO3разб. + Be | 19. Ni + H2O + O2 HNO3разб. + Pb |
| 5.Al + NaOH + H2O HNO3разб. + Cd | 20. Pb + KOH + H2O + O2 HNO3разб. + Cr |
| 6. Cu + H2O + O2 HNO3разб. + Mg | 21. Cr + KOH + H2O + O2 H2SO4конц., t° + Al |
| 7. Cu + NaOH + H2O + O2 HNO3конц. + Ba | 22. Pb + H2O + O2 HNO3разб. + Bi |
| 8. Fe + H2O + O2 HNO3конц. + Pb | 23. Bi + KOH + H2O + O2 HNO3конц., t° + Ni |
| 9. Cr + H2O HNO3разб. + Fe ® Fe3+ | 24. Cr + HCl H2SO4конц. + Mg |
| 10. Zn + H2O H2SO4конц., t° + Al ® | 25. Al + HCl Zn + NaOH + H2O |
| 11. Zn + NaOH + H2O H2SO4конц., t° + Ni ® | 26. Ti + H2SO4конц., t° Cd + KOH + H2O + O2 |
| 12. Zn + H2SO4разб. +O2 HNO3конц., t° + Fe ® Fe3+ | 27. Ti + HNO3разб. Cd + KOH + H2O |
| 13. Cr + H2O + O2 HNO3разб. +Cu | 28. Cd + HCl + O2 Be + H2SO4конц. |
| 14. Zn + NaOH + H2O + O2 H2SO4конц., t° + Fe ® Fe3+ | 29. Fe + KOH + H2O + O2 Ag + HNO3 конц. |
| 15. Cr + NaOH + H2O HNO3разб. + Sn | 30. Ni + KOH + H2O + O2 Mn + H2SO4конц. |
Задание 4. Составьте электронную схему и молекулярное уравнение окислительно-восстановительной реакции (см. таблицу электродных потенциалов).
1. KMnO4 + MnSO4 + H2O → MnO2 + …
2. FeSO4 + K2Cr2O7 + H2SO4 →
3. NaCrO2 + H2O2 + NaOH →
4. Ni(OH)2 + Br2 + NaOH →
5. Co(OH)3 + HCl →
6. Fe(OH)2 + O2 + H2O →
7. Cr2O3 + KClO3 + NaOH →
8. TiOSO4 + Zn + H2SO4 →
9. N2H4 + Zn + KOH + H2O → [Zn(OH)4]2- +...
10. CrCl3 + HCl + Zn → CrCl2 +...
11. KBr + KMnO4 + H2SO4 →
12. Na2MoO4 + HCl + Al → MoCl2+ …
13. C6H12O6 + KMnO4 + H2SO4 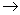 CO2 + ….
CO2 + ….
14. FeS2 + HNO3(конц.) → NO + …
15. MnSO4 + NaBiO3 + HNO3 →
16. Bi(NO3)3 + Na2S2O8 + NaOH →
17. PbS + HNO3 → NO2 + …
18. C2H2O4 + KMnO4 + H2SO4 → CO2 + ….
19. KI + K2Cr2O7 + H2SO4 → I2 + ….
20. Bi(NO3)3 + Br2 + KOH →
21. CrCl3 + H2O2 + KOH →
22. KMnO4 + H2O2 + H2SO4 →
23. MnO2 + HCl →
24. MnO2 + KI + H2SO4 → I2+ ….
25. PbS + H2O2 + H2SO4 →
26. H2O2 + Hg(NO3)2 + NaOH → Hg + ….
27. Fe2O3 + KNO3 + KOH → NO2 - + ….
28. FeCl3 + Br2 + KOH → FeO42 - + ….
29. NaCrO2 + NaClO + NaOH ®
30. SnSO4 + Ag2O3+NaOH ® AgO + ….
Тема 2б: «Неметаллы»
Задание 1: Составьте электронную формулу для указанного атома элемента. Укажите низшую и высшую его степень окисления. Приведите формулы оксидов и гидроксидов в характерных для данного элемента степенях окисления и укажите их характер.
| № варианта | Элемент |
| 1/16 | B |
| 2/17 | C |
| 3/18 | N |
| 4/19 | S |
| 5/20 | Cl |
| 6/21 | Br |
| 7/22 | Se |
| 8/23 | As |
| 9/24 | Sb |
| 10/25 | I |
| 11/26 | Si |
| 12/27 | P |
| 13/28 | At |
| 14/29 | F |
| 15/30 | H |
Задание 2. Составьте электронную схему и молекулярное уравнение окислительно-восстановительной реакции (см. таблицу электродных потенциалов).
1. С + HNO3 →
2. S + HNO3 →
3. Na2SeO3 + KBrO +H2O ®
4. NaNO2 + Na2S + H2SO4 ® NO + ….
5. Na2SeO3 + SO2 + H2O ®
6. HClO + SO2 + H2O ® Cl2 +…..
7. Cl2 + J2 + KOH ® JO3- +…..
8. Na2SO3 + NaClO3 + H2SO4 ®
9. J2 + KOH ®
10. H2SO3 + H2S ® S
11. H3AsO3 + I2 + H2O ®
12. H2S + Cl2 + H2O ®
13. Sb2O3 + HBrO3 ®
14. KIO3 + KI + H2SO4 ®
15. I2 + Cl2 + H2O ®
16. Cl2 + KOH ®
17. H2O2 + I2+ H2O ® HIO3 +….
18. H2O2 + As2S3 + NH4OH → (NH4)3AsO4 + S+…
19. H2O2 + H2S + H2O ®
20. Na2O + KI + H2SO4 ®
21. KIO4 + Br2 + KOH ® BrO3 - + …
22. Cl2 + NO + H2O ® NO3 - + …
23. H2S + HClO + H2O →
24. HCl + HNO3 →
25. KI + HNO3 → NO + …
26. SO2 + NaIO3 + H2O → I - + …
27. H3PO3 + KMnO4 + H2SO4 → H3PO4 +..
28. Na3AsO3 + I2 + H2O ®
29. I2 + Na2SO3 + H2O ®
30. NH2OH + I2 + H2O ® N2 + ….
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н.В. Общая химия: учебник для вузов /Н. В. Коровин. – 10-е изд., испр. – М.: Высшая школа, 2008. – 557 с.
2. Угай А.Я. Общая и неорганическая химия: учебник для вузов /А.Я.Угай. – 5-е изд., испр. – М.: Высшая школа, 2007. – 527 с.
3. Гельфман М.И. Химия: учебник для студентов, обучающихся по техническим специальностям и направлениям / М.И. Гельфман, В.П. Юстратов. – 3-е изд., стер. – СПб.; М.; Краснодар: Лань, 2003. – 480 с.
4. Глинка Н.Л. Общая химия: учебное пособие для вузов /Н.Л.Глинка; под ред. А.И. Ермакова. – 30-е изд. испр. – М.: Интеграл-ПРЕСС, 2009. – 728 с.
5. Глинка Н.Л. Задачи и упражнения по общей химии: учебное пособие для студентов нехим. специальностей /Н.Л.Глинка; под ред. В.А. Рабиновича, Х.М. Рубинной. – Изд. стер. – М.: Интеграл–ПРЕСС, 2006. – 204 с.
6. Краткий справочник физико-химических величин /Под ред. А. Равделя, А.М. Пономаревой. – Л.: Химия, 1986. – 232 с.
ПРИЛОЖЕНИЕ
СПРАВОЧНЫЙ МАТЕРИАЛ
Таблица П.1