Несмотря на существование проблем идентификации компартментов эндоцитозного пути, многочисленные исследования позволили выявить некоторые закономерности (рис. 8).
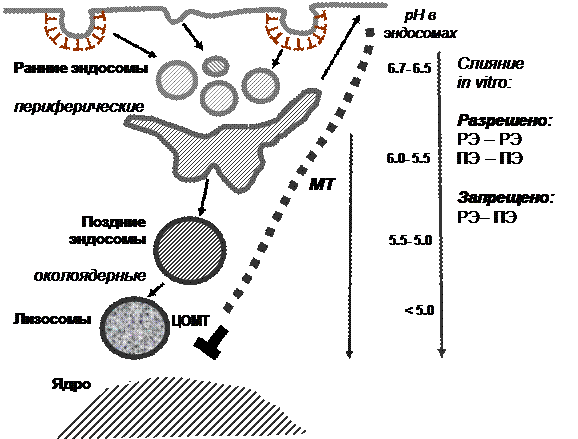
Рис. 8. Общая характеристика эндоцитозного пути.
РЭ – ранние эндосомы; ПЭ – поздние эндосомы
Во-первых, эндоцитозный путь имеет векторную организацию – от мембраны к околоядерной области, – за счет того, что транспорт эндосом происходит по микротрубочкам, наиболее часто организованным в радиальную сеть с центром схождения в околоядерной области (им часто является ЦОМТ, центр организации микротрубочек). Ранние эндосомы располагаются преимущественно на периферии клетки. С течением времени грузы обнаруживаются в более крупных эндосомах, которые находятся в околоядерной области, расположенной в непосредственной близости от центра организации микротрубочек. Таким образом, для появления груза в поздних околоядерных эндосомах необходимы микротрубочки. Предполагалось, что околоядерные эндосомы ― это уже поздние эндосомы и их локализация облегчает взаимодействие с лизосомами, также расположенными преимущественно около ядра, рядом с ЦОМТ.
Во-вторых, было доказано, что по ходу эндоцитозного пути происходит закисление внутреннего пространства эндосом за счет работы протонной вакуолярной помпы, встроенной в мембрану эндосом.
В третьих, исследования слияния эндосом в системах in vitro показало, что существуют ограничения в слиянии эндосом друг с другом. Так, ранние эндосомы способны сливаться с ранними, а поздние ― с поздними, что говорит об общих свойствах их мембран (в этом случае мембраны называется гомотипичными), тогда как гетеротипические слияния (ранних эндосом с поздними) практически не происходят. Невозможность гетеротипических слияний отражает существенные различия в свойствах мембран ранних и поздних эндосом.
 2.2.4. Ранние эндосомы ― главная сортирующая стадия эндоцитозного пути. Возможные механизмы сортировки
2.2.4. Ранние эндосомы ― главная сортирующая стадия эндоцитозного пути. Возможные механизмы сортировки
на путь рециклирования и лизосомной деградации
Задачи, которые клетка решает с помощью эндоцитоза, достаточно широки. Так, пиноцитоз позволяет изменять площадь поверхности мембраны, например, при движении клетки. Эндоцитоз метаболических рецепторов призван снабжать клетку уже готовыми питательными веществами и строительным материалом, которые она не может синтезировать сама. Например, трансферрин (в комплексе с рецептором трансферрина) связывает ионы железа во внеклеточном пространстве, и с помощью РОЭ переносит их в эндосомы, откуда они поступают в цитоплазму. Очевидно, что в этом случае направлять рецепторы на деградацию в лизосомы было бы слишком расточительно. Действительно, большинство комплексов лигандов и метаболических рецепторов после интернализации диссоциируют, при этом лиганды, как правило, направляются в лизосомы, а рецепторы рециклируют обратно на поверхность, чтобы принять участие в новых раундах эндоцитоза.
Многие молекулы, принимающие участие в проведении сигналов (например, пептидные факторы роста), реализуют свое действие на клетку через специфические мембранные рецепторы, которые и являются истинными «сигнальными молекулами». Разные классы таких лиганд-рецепторных комплексов также интернализуются, но в общем случае и лиганд, и рецептор может ожидать различная судьба. Так, оба, в отличие от метаболических рецепторов и их лигандов, могут доставляться в лизосомы. С одной стороны, это позволяет убрать «лишние» рецепторы с мембраны и тем самым уменьшить стимулируемый лигандом сигнал. С другой стороны, лиганд-рецепторные комплексы в эндосомах способны генерировать собственные сигналы. В определенных условиях сигнальные лиганд-рецепторные комплексы могут рециклировать, а соотношение между путем рециклирования и дергадации будет определять длительность и интенсивность генерируемых сигналов.
Разнообразные молекулы-грузы, попадая в клетку через различные порталы, оказываются в ранних эндосомах, которые могут сливаться, что приводит к перемешиванию грузов. Учитывая вышесказанное, основная задача ранних эндосом – рассортировать грузы и направить каждый по нужному пути. Таким образом, если на биосинтетическом пути сортировка грузов происходит на выходе из АГ, то на эндоцитозном пути основной «сортирующей станцией» являются ранние эндосомы. Фактически, из ранних эндосом берут начало различные пути, ведущие ко всем компартментам. Основными являются пути рециклирования на плазматическую мембрану и путь лизосомной деградации. Через ранние эндосомы идет трансцитозный путь. Возможна также доставка грузов к транс-Гольджи и ЭПР.
Механизмы, обеспечивающие сортировку, давно занимали умы исследователей. Работы 80-х–90-х годов позволили сформулировать гипотезы, связывавшие сортировку с тубуловезикулярной морфологией ранних эндосом и со сниженным уровнем эндосомного рН.
Действительно, было замечено, что различные лиганд-рецепторные комплексы диссоциируют при достижении определенного уровня pH в эндосомах. Лиганды при этом переходят в жидкую фазу люмена эндосомы, тогда как рецепторы остаются в мембране. Высказывались предположения, что разделение лигандов и рецепторов основано на соотношении объема к площади поверхности эндосомы. Действительно, если предположить, что диссоциировавший лиганд равномерно распределен в объеме эндосомы (в «жидкой фазе»), а рецептор ― в мембране, то везикулярная часть эндосомы будет содержать преимущественно лиганд (отношение площади поверхности к объему сравнительно мало), а тубулярный отросток ― преимущественно рецептор (отношение площади поверхности к объему велико). Таким образом, считали, что из тубулярных частей эндосомы идет рециклирование, тогда как из везикулярной части идет перенос груза в поздние эндосомы и далее в лизосомы. Как будет обсуждаться в дальнейших главах, эти моменты действительно существенны для сортировки, однако они носят вероятностный характер, не позволяя избирательно включать в определенные везикулы молекулы только одного типа и исключать другие. Сейчас уже стало очевидно, что специфические активные механизмы играют более значительную роль в процессе сортировки, позволяя не только сегрегировать определенные грузы в разных доменах эндосомной мембраны, но и концентрировать их там. Тем не менее, подавление градиента рН вдоль эндоцитозного пути способно изменить внутриклеточную судьбу интернализованного груза.
2.2.5. Проблемы идентификации ранних и поздних
эндосом. Современные представления об организации эндоцитозного пути. Роль мультивезикулярных эндосом и лизосом
Как уже упоминалось в главе, посвященной описанию основных эндоцитозных компартментов, исследователи с самого начала столкнулись с большими трудностями в определении ряда ключевых вопросов организации эндоцитозного пути. Во-первых, гетерогенная, в основном везикулярная морфология эндосом, не позволяла точно определить границу между ранними и поздними эндосомами. Поэтому природа поздних эндосом была абсолютно непонятна и вызывала многочисленные споры. Было совершенно неясно, как груз
передается из ранних эндосом в поздние, и почему доставка в поздние эндосомы необходима для последующей деградации груза в лизосомах. Много вопросов возникало в связи с ролью мультивезикулярных тел (МВТ), поскольку, с одной стороны, эти органеллы всегда наблюдались в клетках, в которых был стимулирован путь лизосомной деградации, а с другой стороны, механизм формирования этих структур был неясен.
Существенная неопределенность привела к тому, что на основании практически одной и той же совокупности данных разными исследователями были предложены принципиально различные гипотезы организации эндоцитозного пути (рис. 9)
Одна из основных гипотез (автором ее являлся Г. Гриффитс) исходила из идеи о том, что эндоцитозный путь ничем не хуже экзоцитозного, и должен быть организован «симметрично». Это означает, что если на антероградном пути имеются два стабильных, «предсуществующих» (по терминологии Гриффитса) компартмента – ЭПР и АГ, – сообщение между которыми осуществляется с помощью везикул, то и ранние и поздние эндосомы также должны быть стабильными, «предсуществующими», компарментами, взаимодействующими с помощью везикул-переносчиков. В соответствии с этим основным постулатом теория получила название гипотезы «эндосомных везикул-переносчиков» (e ndosomal c arrier v esicles, ECVs hypothesis). Невозможность гетеропипического слияния

|
|

|



Рис. 9. Сравнение представлений об организации
эндоцитозного пути с точки зрения гипотезы эндосомальных
везикул-переносчиков и гипотезы созревания эндосом
в этом контексте рассматривалась в качестве подтверждения кардинальных отличий мембран ранних и поздних эндосом как мембран разных компартентов.
Предполагалось, что первичные эндосомы, отпочковавшиеся от ПМ, содержащие как белки жидкой фазы, так и мембранные, далее сливаются с сетью тубуловезикулярных ранних, или сортирующих, эндосом. Белки, отправляемые в поздние эндосомы, концентрируются в тех везикулярных доменах эндосом, из которых далее формируются везикулы-переносчики. На роль везикул-переносчиков в контексте этой гипотезы претендовали именно МВТ. Авторы считали, что на самом деле внутренние включения не отделены от внешней мембраны МВТ, а организованы складками этой мембраны наподобие митохондриальных крист. Предполагалось, что именно для формирования ECV и их отщепления от РЭ требовалось снижение уровня рН. Далее по микротрубочкам МВТ-ECV путешествовали в околоядерную область, где сливались с позднеэндосомальным компартментом, представленным, по мнению авторов, однойобщей структурой. В этом контексте места лизосомам не оставалось, так как создатели гипотезы предлагали рассматривать именно поздние эндосомы в качестве основного деградационного компартментом клетки. Действительно, во фракции изолированных поздних эндосом экспериментально обнаруживали активности ряда лизосомных ферментов, хотя во фракции лизосом эта активность была на порядок выше. Тем не менее, в рамках описываемой гипотезы лизосомам отводилась незавидная роль депо запасных лизосомных ферментов и хранилищ разного неполностью переваренного материала.
Эта гипотеза содержала и другие сомнительные моменты. Так, например, должен был существовать узкий промежуток времени, в течение которого вероятность слияний эндосом, изолированных до него и после него, падала бы скачкообразно, соответствующий моменту отделения везикулы-переносчика от ранней эндосомы. Однако проводимые в то же время несколькими группами ученых эксперименты показали, что жестких запретов на слияние ранних и поздних эндосом нет. Действительно, вероятность слияния эндосом падает с увеличением промежутка времени, после которого получали фракцию поздних эндосом, но эта вероятность падает постепенно, так же как постепенно уменьшается вероятность рециклирования.
Кроме того, было обнаружено, что при одновременном эндоцитозе разных грузов, направляемых на рециклирование и на деградацию (например, рецепторы трансферрина и рецепторы факторов роста), оба груза выявлялись сначала в одних и тех же периферических тубуло-везикулярных эндосомах, а с течением времени – в одних и тех же МВТ. Однако рециклирующий груз все время оставался на внешней мембране эндосом, тогда как груз, направляемый на деградацию, постепенно накапливался во внутренних пузырьках мультивезикулярных тел. Более того, в изолированной фракции наиболее тяжелых и электронно-плотных структур, содержащих максимальный уровень лизосомных ферментов и традиционно считающейся фракцией вторичных лизосом, выявлялись типичные МВТ, плотно забитые мелкими внутренними пузырьками. Именно эти структуры во множестве и окружали центр организации микротрубочек, не оставляя места для какого либо иного крупного мембранного компартмента.
Таким образом, реально наблюдались ранние периферические тубуло-везикулярные структуры с признаками начальной стадии формирования внутренних пузырьков (инвагинации мембраны эндосомы). Далее эти эндосомы перемещались в околоядерную область, параллельно увеличивая количество внутренних пузырьков. В конечном итоге формировались плотно упакованные МВЭ, образующие кластер в околоядерной области. После этого во внеклеточной среде начинали появляться продукты расщепления белков-грузов.
Такой сценарий развития событий, имеющий гораздо более прочное экспериментальное обоснование (благодаря работам разных исследовательских групп, первой из которых была группа проф. Мэрфи), получил название«гипотезы созревания эндосом» и в настоящее время является общепризнанным.
Итак, можно считать, что «с точки зрения груза» вступление его на путь деградации означает попадание в везикулярный домен ранней эндосомы. Далее все события развиваются на одной той же мембране, свойства которой постепенно изменяются. Во-первых, рециклирующие белки с их липидным окружением покидают эндосому, тогда как в ее мембрану встраиваются пузырьки, несущие материал из транс-Гольджи. Эндосомы с течением времени перемещаются в околоядерную область и укрупняются за счет множественных гомотипичных слияний друг с другом. Существенно подчеркнуть, что хотя превращение ранних эндосом в поздние мультвезикулярные идет не одномоментно, этот процесс в основном локализован именно в околоядерной области. Это означает, что околоядерные эндосомы не являются априори поздними, а формирование инвагинаций и далее внутренних пузырьков в основном инициируется после прибытия эндосом в околоядерную область. Такое расположение существенно сокращает и путь от TGN до эндосом.
Рециклирование идет в два этапа: первый может начинаться сразу же после интернализации и t1/2 этой волны обычно от 2 до 10 мин, тогда как второй «длинный» цикл связан с путешествием рециклирующих грузов в околоядерную область и формированием рециклирующих эндосом именно там. Таким путем, например, идет рециклирование рецептора трансферрина. Возможно, необходимость столь длинного круга связана с тем, что высвобождение железа в случае трансферрина или других лигандов в иных случаях требует, как упоминалось выше, сниженного уровня рН, и такой уровень в эндосомах достигается лишь через 20–40 мин эндоцитоза. В этой связи часто говорят о «позднем рециклирующем компартменте» с околоядерной локализацией, но с наибольшей вероятностью этот «компартмент» высокодинамичен и его наличие или отсутствие (т. е. присутствие скопления везикул, содержащих рециклирующие молекулы), зависит от скорости транспорта и количества материала, который клетке необходимо вернуть на поверхность.
Итак, основные события процесса созревания эндосом, приводящего к их превращению в поздние, происходят в околоядерной области. В дальнейшем мы подробно рассмотрим молекулярные аспекты созревания. Необходимо подчеркнуть, что процесс этот многостадийный, занимает достаточно много времени (от десятков минут до нескольких часов) и идет несинхронно, в результате чего клетка может содержать набор поздних эндосомах различной степени зрелости.
На заключительном этапе созревания мультивезикулярные поздние эндосомы, содержащие все предназначенные для деградации мембранные белки во внутренних пузырьках, становятся компетентными для взаимодействия с первичными лизосомами (это означает, что их мембрана приобретает свойства, которые делают возможным ее взаимодействие с мембраной первичной лизосомы). Первичные лизосомы, как правило, представляют собой некрупные везикулы (около 100 нм), с нейтральным внутренним рН и высокой концентрацией лизосомных гидролаз. Учитывая, что рН-оптимум для большинства этих ферментов находится в кислой области, они активируются только после слияния с поздними закисленными эндосомами.
В соответствии с принятой в настоящее время точкой зрения (рис. 10), взаимодействие эндосом с лизосомами сводится к образованию так называемых гибридных эндо-лизосом, т. е. происходит по механизму временного слияния, называемому “kiss-and-run”. За время существования гибридной органеллы мембраны двух везикул перемешиваются, и активные гидролазы расщепляют белки и липиды, предназначенные для деградации. Затем, наступает этап сегрегации, в ходе которого лизосома «собирает» свои ферменты, структурные белки и мембраны и отсоединяется от бывшей поздней эндосомы, которая теперь содержит продукты деградации (часть из них, например, некоторые аминокислоты, могут покидать ее, непосредственно проходя через мембрану в цитоплазму). Именно такие структуры, и остатки мембран, обычно электронно-плотные при электронно-микроскопическом анализе и наиболее тяжелые при субклеточном фракционированиии, и называются лизосомами, хотя терминологически более точно будет называть их «вторичными лизосомами».





Рис. 10. Поздние этапы деградационного эндоцитозного пути:
а) – зрелые МВТ могут сливаться с плазматической
мембраной (например в антиген-презентирующих клетках);
б) – взаимодействие и дальнейшая судьба зрелой поздней
эндосомы после ее встречи с первичной лизосомой
Большинство описаний деградационного эндоцитозного пути на этом завершается, хотя в действительности последней стадией эндоцитозного пути является перемещение вторичных лизосом по микротрубочкам к плазматической мембране и слияние с ней (возможно, неполное). В результате продукты деградации и внутренние пузырьки секретируются в окружающую среду. Интересно, что не только лизосомы, но и мультивезикулярные тела могут сливаться с плазматической мембраной, и эта способность используется в процессе презентации антигенов, поскольку внутренние пузырьки (называемые в этом случае экзосомами) содержат экспонированные на их поверхности фрагменты антигенов, получившихся в результате частичной деградации. Таким образом, эндоцитозный путь, начинаясь на плазматической мембране, на ней же и завершается.
Существует еще один процесс большой физиологической значимости, связаный с эндосомами ― это процесс аутофагии. Как известно, в неблагоприятных условиях (голодание, стресс) или при изменении редокс-статуса клетка может вступить на путь экономии энергозатрат, запустив механизмы, в результате работы которых часть цитоплазмы с содержащимися в ней органеллами (митохондриями, пероксисомами и др.) оказывается окруженным двойным слоем мембран – аутофагосомой. Уже из названия следует, что конечной судьбой содержимого аутофагосомы является его деградация после слияния с лизосомами. Относительно происхождения мембран аутофагосом окончательного мнения еще не сформировалось, однако высока вероятность того, что ранние эндосомы принимают самое активное участие в формировании аутофагосомы. Существующие на этот момент данные о возникновении аутофагосом и регуляции этого процесса будут рассмотрены в последующих частях пособия.
3. ФОРМИРОВАНИЕ ТРАНСПОРТНЫХ ПУЗЫРЬКОВ
3.1. ОКАЙМЛЕНИЯ И ИХ ТИПЫ
Как упоминалось выше, формирование транспортного пузырька связано с возникновением «почки», или инвагинации мембраны, направленной из люмена органеллы в цитоплазму. На этой стадии ключевую роль играют так называемые белки окаймлений, обеспечивающие специфичность места и времени возникновения транспортной везикулы и селекцию конкретного груза.
В настоящее время выделяют несколько типов окаймлений: COPI и COPII (название происходит от слов co at p roteins, или белки окаймления) и несколько типов так называемых «клатриновых окаймлений». К последним относятся гетеротетрамерные AP (a daptor p roteins) окаймления АР1, АР2, АР3 и АР4, мономерные АР180 и GGA1-3. Клатриновыми эти окаймления назвали потому, что общим для всех них компонентом является гексамерный белок клатрин, за исключением АР3-окаймления, работающего без клатрина. Следует отметить, что кажущееся разнообразие на самом деле не так велико, поскольку некоторые (в основном крупные) субъединицы всех окаймлений (и СОР, и «клатриновых) обладают значительной степенью гомологии и, возможно, произошли от одного общего предшественника. Далее, в ходе эволюции адаптивные механизмы уже привели к многочисленным «вариациям на тему», обеспечивающим большую специфичность как по отношению к конкретным транспортным путям, так и по отношению к грузам. Участки транспортных путей, на которых работают те или иные окаймления, представлены на рис. 11. Из схемы видно, что COP-окаймления обслуживают в основном прямой и обратный транспорт по биосинтетическому пути, тогда как клатриновые окаймления участвуют в формировании везикул в ходе эндо- и экзоцитоза.

Рис. 11. Участки транспортных путей, обслуживаемые
окаймлениями разных типов
Не исключена вероятность того, что существуют и неизвестные пока окаймления, поскольку не для всех транспортных путей они определены (например, неясно, какое окаймление участвует в формировании пиноцитозных пузырьков).
3.2. СОРI ОКАЙМЛЕНИЕ
По существующим в настоящее время представлениям, СОРI обслуживает транспорт между цистернами аппарата Гольджи (так называемый интра-Гольджи транспорт, intraGolgi traffic) и возврат резидентных белков ЭПР обратно из цис- цистерны в ЭПР.
Попытки реконструкции формирования COPI-окаймлений в системе in vitro, показали, что для образования COPI-окаймленных пузырьков необходимы три компонента (так называемая «минимальная система»): липосома, содержащая кислые липиды (1), мультимерный белковый комплекс «коутомер» (coatomer) (2) и малая ГТФаза семейства Arf, Arf1, названная инициирующей по ее роли в формировании окаймления.

Рис.12. Субъединичная организация
СОРI- окаймления
Коутомер состоит из субъединиц различного размера (от 20 до 160 кДа) и существует в цитоплазме ввиде комплекса, не диссоциируя. По всей видимости, состав коутомера может варьировать благодаря наличию изоформ некоторых субъединиц.
Малая ГТФаза Arf1 заякоривается в мембране благодаря наличию остатка миристиловой кислоты. В ГДФ-связанном состоянии Arf1 неактивна и локализована в цитозоле. Ее конформация в этом случае позволяет образовать карман, экранирующий гидрофобный миристиловый хвост от гидрофильного окружения цитоплазмы. Ассоциация с мембраной растворимого GEF для Arf1 приводит к ее связыванию с GEF и заменой ГДФ на ГТФ, т. е. к активации малой ГТФазы (рис. 13). На природных мембранах АГ активная Arf1 рекрутирует фермент липидного обмена фосфолипазу D (PLD), которая расщепляет фосфатидилхолин цитоплазматического слоя мембраны АГ на холин и фосфатидную кислоту, несущую отрицательный заряд. Предполагают, что образование мембранных доменов, обогащенных этим липидом, приводит к увеличению расстояния между молекулами внешнего слоя и, таким образом, инициирует начальное искривление мембраны в месте локализации комплекса GEF-Arf1-ГТФ и PLD.

Рис. 13. Сборка COPI-окаймления
На следующем этапе параллельно происходит несколько процессов. Во-первых, активный Arf1 начинает рекрутировать (привлекать) из цитоплазмы коутомеры к месту образования пузырька, что в конечном итоге приводит к формированию сполошного окаймления; во-вторых, идет процесс наполнения везикулы и регуляторными компонентами, отвечающими за правильную доставку и слияние с мембраной-мишенью, и молекулами-грузами. Грузами для COPI–везикул являются в основном резидентные белки ЭПР, обладающие сигнальными последовательностями KKXX и KDEL. В мембране ЭПР и цис-АГ существуют рецепторы, узнающие белки с этими последовательностями (ERD-рецепторы), а субъединицы коутомера и регуляторных белков также имеют домены, способные связываться как с рецепторми, так и их грузом.
После завершения формирования пузырька, когда коутомеры образуют сплошное покрытие, а мембрана везикулы искривляется настолько, что формируется пузырек, связанный с мембраной ЭПР только через тонкую «шейку», активируется GAP для Arf1, происходит гидролиз ГТФ, везикула отшнуровывается от мембраны-донора и начинает терять свое окаймление, поскольку Arf1 переходит в неактивное состояние.
Таким образом, весь процесс инициируется связыванием с мембраной Arf1-ГТФ, искривление мембраны происходит как за счет модификации липидов, так и за счет сил, развивающихся при кластеризации коутомеров, а гидролиз ГТФ, приводящий к разборке окаймления и появлению готового к транспортировке пузырька с грузом, должен происходить на самой последней стадии.
Однако оказалось, что динамика гидролиза ГТФ имеет весьма сложный характер. Действительно, если исходить из предложенной схемы, то добавление в систему in vitro негидролизуемого аналога ГТФ, ГТФ-γS, должно способствовать накоплению неотшнурованных окаймленных пузырьков. На деле же выяснилось, что невозможность гидролиза ГТФ блокирует процесс на гораздо более ранней стадии, а именно, подавляет накопление груза. В настоящее время говорят о существовании двух GAP-активностей. Циклы гидролиза ГТФ на Arf1 под действием «медленной» ГТФазы необходимы для накопления груза; она создает временн о е окно, в течение которого пузырек заполняется грузом.
«Быстрая» GAP-активность работает один раз на последнем этапе – после полной сборки окаймления следует быстрый гидролиз ГТФ на Arf1, отделение пузырька и разборка окаймления. Интересно, что коутомер не является ArfGAP, тем не менее, его ассоциация с везикулой значительно ускоряет гидролиз ГТФ.
COPI обнаруживают не только на мембранах АГ, но также и на эндосомах. Однако в составе коутомера отсутствуют гамма- и бета-субъединицы; бета-COP посттрансляционно модифицирован (возможно, фосфорилирован); при этом COPI на эндосомах мало по сравнению с мембранами АГ. Роль этих СОРI-комплексов не вполне ясна, однако известно, что дефекты по эпсилон-COP препятствуют образованию мультивезикулярных тел (!), а ассоциация с мембраной зависит от Rab-белков, а не Arf1. Все это позволяет предполагать, что элементы COPI на эндосомах работают не как окаймления, а скорее как сортирующая платформа, существенная для формирования поздних эндосом.
3.3. COPII-ОКАЙМЛЕНИЕ
COPII-окаймление обслуживает начальный участок биосинтетического пути, участвуя в формировании транспортных пузырьков в «сайтах выхода» (exit sites) на мембранах ЭПР, несущих вновь синтезированные белки от ЭПР к цис-Гольджи (вернее, к тубуло-везикулярному кластеру цис-Гольджи). Это окаймление формируется по тому же принципу, что и COPII: процесс начинает инициирующая ГТФаза, которая затем рекрутирует белковые комплексы окаймления. Однако в деталях существует много различий. Так, малая, инициирующая ГТФаза, которой в данной случае является Sar1p, переводится в активное состояние с помощью GEF Sec12, который постоянно локализован в мембране ЭПР. Далее, хотя в минимальной системе для формирования COPII-окаймленных везикул липосомы должны содержать кислые липиды во внешнем слое, данных об участии ферментов липидного обмена в этом случае нет. В-третьих, белковые комплексы окаймления организованы сложнее: имеются димеры белков Sec23/Sec24, которые рекрутируются к формирующейся везикуле активированным Sar1p. Эти димеры имеют сайт связывания как с регуляторными элементами (SNARE), так и с мембранно-связанными грузами или рецепторами растворимых грузов. Далее, к окаймлению присоединяются димер Sec13/Sec31 и белок скэффолда Sec16, способный создавать кластеры из нескольких различных димеров. Сборка этих комплексов приводит к конформационному изменению, названному полимеризацией (этот термин широко применяется в литературе, хотя никаких ковалентных связей между разными димерами не возникает). Присоединение остальных участников окаймления активирует GAP для Sar1p, коим является Sec24. В результате происходит искривление поверхности инвагинации, достаточное для формирования везикулы, и гидролиз ГТФ на Sar1p, что приводит к отшнуровыванию пузырька и разборке окаймления. Возможность того, что в этом случае, как и для COPI, существуют медленные и быстрые циклы гидролиза ГТФ, не исключена, но не доказана.
Биосинтетический путь исключительно важен для клетки, и компоненты транспортной машинерии, работающие здесь, весьма консервативны от дрожжей до млекопитающих. Терминология, приведенная выше, была введена в работах на дрожжевых системах, и хотя для млекопитающих чаще употребляют названия «р13/p31», «p23/p24» и т. д., названия «p» и «Sec» равноупотребимы.
3.4. КЛАТРИНОВЫЕ ОКАЙМЛЕНИЯ. СТРОЕНИЕ АДАПТОРНЫХ КОМПЛЕКСОВ
СЕМЕЙСТВА АР И GGA. КЛАТРИН
Субъединицы комплексов называются адаптинами и обозначаются по степени гомологии и в порядке убывания мол. массы β1-β4 (big, 100 кДа), μ1-4 (medium, ок. 50 кДа), ϭ (small, 15–20 кДа). Четвертые субъединицы комплексов (160 кДа) относительно менее гомологичны, и часто называются вариабельными, поэтому они удостоились индивидуальных буквенных наименований: γ (АР1), α (AP2), δ (АР3), ε (АР4). Две наибольшие субъединицы каждого комплекса организованы осесимметрично: их СООН-домены образуют глобулу (year), связанную с NH2-концевым глобулярным доменом (head) довольно жестко организованным линейным мостиком (hindge). Малая и средняя субъединицы связаны с «головной» областью двух больших субъединиц и друг с другом. Таким образом, АР-комплекс имеет характерный вид «головы с ушами» (Рис. 14). Ухо β1-4 субъединиц отвечают за связывание с клатрином, голова вариабельных и μ1-4 субъединицы определяют связывание с грузом, тогда как ϭ1-4 определяют локализацию окаймления. Очень важную роль играет «ухо» вариабельной субъединицы, поскольку именно там находятся последовательности, с которыми взаимодействуют регуляторные белки, определяющие последовательность формирования окаймления.
 |
Рис. 14. Строение гетеромерных адапторных
комплексов АР1-4
Мономерные адапторные белки семейства GGA (Golgi-localized adaptor, γ-ear containing, ARF1- binding protein) 1, 2, 3 фактически представляют собой изоформы γ-субъединицы АР1 комплекса.
Мономерный АР180 играет важную роль в формировании клатринового окаймления на плазматической мембране и среди всех адаптинов обладает наибольшим сродством к клатрину.
Клатрин представляет собой гексамер характерной формы, содержащий три легкие и три тяжелые цепи, попарно образующие узел (hub) своими С-терминальными доменами (рис. 15). Эта структура получила название трискелион. Трискелионы при определенных условиях (рН 6.7, Mg2+) обладают способностью к самосборке, образуя плоские решетки, состоящие из гексагонов.

Рис. 15. Строение клатринового трискелиона (слева) и
образованная из трискелионов плоская решетка (справа)
В присутствии липосом небольшого диаметра (80–100 нм) трискелионы собираются в ажурную «корзиночку», полностью покрывая липосому. При этом происходит перестройка, механизм которой неизвестен, но в результате часть гексагонов заменяется на пентагоны, что позволяет создать упорядоченную круглую структуру. В нативных условиях формирование клатринового окаймления начинается на плоском участке мембраны, а реорганизации клатриновой сети является движущей силой искривления липидного бислоя.
Плоские клатриновые решетки довольно внушительных размеров (несколько мкм2) выявлены на ранних эндосомах, где их уникальные свойства используются для селекции и концентрирования в ограниченных клатрином областях определенных мембранных белков.