PtdIns синтезируются в АГ и затем транспортируются к плазматической мембране, как правило, в модифицированном виде. Так, сразу после синтеза PtdIns фосфорилируется PI4-киназой. Дополнительное фосфорилирование по 5-му положению создает на мембране сайт связывания фактора GEF для Arf1, что стимулирует формирование экзоцитозных пузырьков с помощью GGA-окаймлений. После встраивания экзоцитозного пузырька в плазматическую мембрану PI(4,5)P2 участвует в заякоривании актинового цитоскелета на мембране через актин-связывающие белки. Кроме того, он фосфорилируется PI3-киназой p85, превращаясь в PI(3,4,5)P3. Кроме ассоциации с сигнальными белками, этот липид участвует в формировании поверхностных протрузий, раффлов, часто дающих начало макропиносомам. Интересно, что PI(4,5)P2 фактически работает координатором экзо- и эндоцитозных потоков, позволяя сохранять баланс мембран в случаях отсутствия специальных сигналов, провоцирующих увеличение площади мембраны в данном участке, поскольку белок семейства синаптотагминов, инициирующий сборку клатринового окаймления, взаимодействует как раз с теми участками мембраны, которые содержат PIP2. Таким образом, уравновешивается количество пузырьков, встроившихся в мембрану в результате экзоцитоза, и отшнуровавшихся эндосом.
Все эти реакции фосфорилирования происходят не только в определенном месте, но и регулируются во времени. Например, PI3-киназа p85 активируется при действии на клетку ростовых факторов, и только тогда в мембране появляется PIP3. Фосфатазы, осуществляющие дефосфорилирование, также подвержены регуляции различными сигналами, таким образом, существование определенных фосфорилированных форм PtdIns четко контролируется сигнальной машинерией клетки.
6.4.2. Фосфоинозитиды на эндоцитозном пути.
Механизм действия Vps34
Ранее уже говорилось о том, что для эндоцитозного пути характерно существование липидных территорий, обогащенных PI3-монофосфатом. Этот липид появляется на мембранах ранних эндосом следующим образом (рис. 31): активированный Rab5 рекрутирует к мембране вспомогательную субъединицу Vps34, p150. Р150 миристилирована и может, таким образом, заякориваться в мембране. Хотя один из ее доменов обладает высокой степенью гомологии с ферментативным доменом серин-треониновых протеинкиназ, но ни субстраты р150, ни ее функциональная роль в этом качестве неизвестны. Связывание р150 с эндосомой вызывает рекрутирование из цитоплазмы Vps34, которая фосфорилирует молекулы PtdIns в непосредственной близости от себя, создавая домены, обогащенные PI3-монофосфатом. Этот домен играет, по крайней мере, тройную роль: во-первых, к нему рекрутируется фактор дистанционного взаимодействия ранних эндосом EEA1(early endosomal autoantigene1), что стимулирует гомотипическое слияние ранних эндосом и их укрупнение. Во-вторых, к этой платформе рекрутируются так называемые ESCRT 0-IV комплексы, которые концентрируют здесь грузы, направляемые на деградацию, через поздние эндосомы.
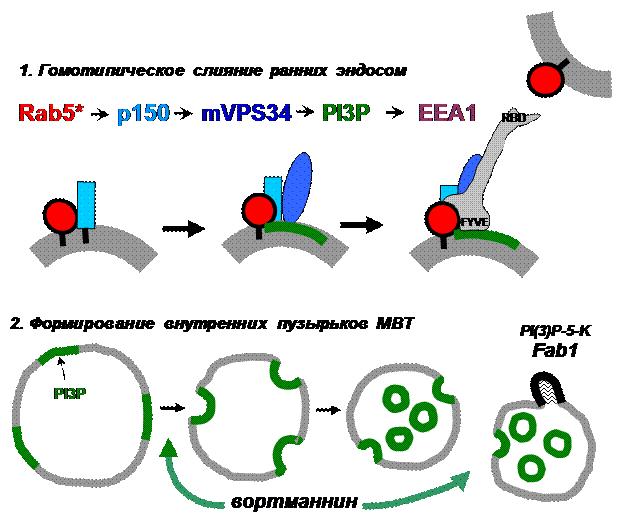
Рис. 31. Этапы эндоцитозного пути, в регуляцию которых
вовлечена PI3-киназа Vps34
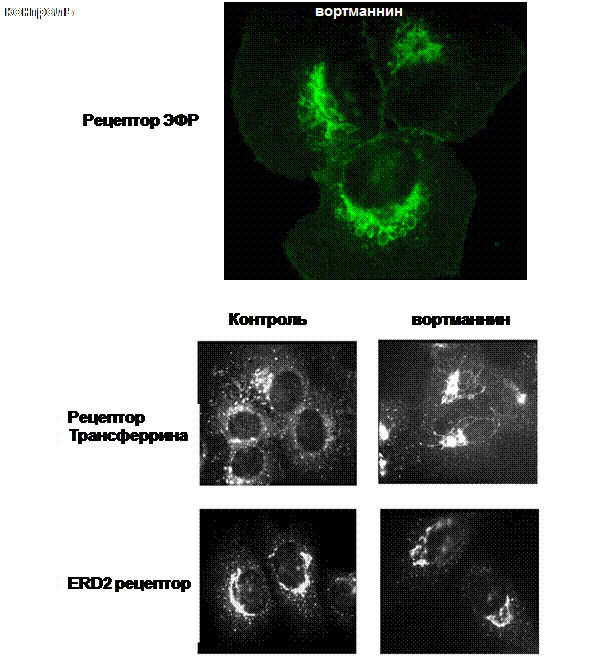
И наконец, из PI3P-доменов формируются инвагинации, дающие начало внутренним пузырькам поздних эндосом. Таким образом, сконцентрированный груз удаляется с внешней мембраны эндосомы и лишается возможности рециклировать. Каким образом PI3P способствует искривлению мембраны в нужном направлении, неизвестно, однако при ингибировании активности Vps34 вортманнином получаются очень крупные эндосомы без внутренних пузырьков, имеющие характеристики ранних эндосом (рис. 32)
 а)
а)
б)
Рис. 32. Ингибитор PI3-киназ вортманнин приводит
к возникновению увеличенных эндосом (а) и тубуляции
рециклирующих (б), не оказывая эффекта на мембраны АГ
На рис. 32: а – иммунофлуоресцентное выявление эндосом, содержащих рецептор ЭФР, в клетках А431, через 60 мин после стимуляции эндоцитоза; б – клетки окрашивали антителами на рециклирующий рецептор трансферрина (верхняя панель) и на маркер мембран АГ рецептор ERD2 (нижняя панель) до (контроль) и через 30 мин после добавления вортманнина. Микрофоторгафии Н. Н. Железновой.
.То, что невозможность формирования внутренних пузырьков МВЭ существенна для созревания ранних эндосом в поздние, подтверждает и подавление вортманнином деградации грузов, направляемых в лизосомы. Предполагается, что рециклирование из поздних эндосом регулируется еще одной фосфатидилинозитолкиназой, – PI3P5K, называемой Fab1, субстратом которой является PI3-монофосфат.
Кроме того, известно, что РI3P на внутренней мембране аутофагосомы на всех стадиях ее формирования.
6.4.3. Механизм действия фосфорилированых
форм PtdIns
Как уже упоминалось, регуляторная роль PtdIns связана с тем, что ряд белков обладает доменами, способными узнавать их определенные фосфорилированные формы и рекрутироваться к мембране в тех сайтах, где они локализованы. Таких доменов на настоящий момент идентифицировано три (рис. 33) – так называемый РН (plekstrin homology) домен, PX-домен, идентифицированный впервые в составе оксидазы p47Phox, и FYVE-домен, название которого является аббревиатурой названий белков Fab1 (PI3P5-киназа, обеспечивающая рециклирование из поздних эндосом), YotB (предположительно – гидролаза бактериального происхождения), дрожжевого белка Vac1, ответственного за сортировку эндоцитировннного груза в вакуоль, и уже известного EEA1. Наибольшей специфичностью обладают FYVE- и РХ-домены, узнающие только PI3P. FYVE-домен содержат также некоторые компоненты эндосомных сортирующих комплексов ESCRT. РХ-домен найден в белках, регулирующих отдельные стадии эндоцитозного пути, например, в SNARE Syn3 и Vam7p. PH-домен малоспецифичен и взаимодействует со всеми фосфо-формами PtdIns. Его содержат такие белки, как динамин, ARNO (GEF для ARF1), сигнальные белки PLCdelta, Akt-киназа и адаптерный белок Sos, связывающий тирозинкиназные рецепторы с МАР-киназным каскадом.
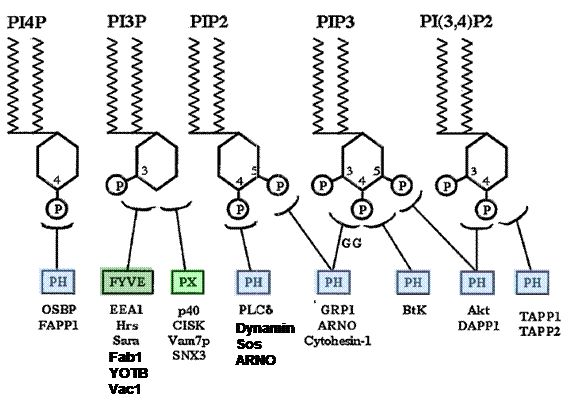
Рис. 33. Белковые домены, узнающие определенные
фосфорилированные формы фосфоиннозитидов. Внизу
приведены примеры белков, обладающих соответствующими
доменами. Расшифровки названий даны в тексте
Таким образом, фосфорилирование PtdIns является механизмом, регулирующим рекрутирование определенных белков к конкретным мембранным сайтам, причем с точки зрения специфичности эндоцитозный путь занимает особое положение – на эндосомах работает уникальный фосфоинозитид, а взаимодействующие с ним белки обладают уникальными доменами узнавания этого липида.
7. РОЛЬ УБИКВИТИНИРОВАНИЯ
В РЕГУЛЯЦИИ ВЕЗИКУЛЯРНОГО
ТРАНСПОРТА БЕЛКОВ
Убиквитинированием называется ковалентное присоединение небольшого консервативного белка убиквити́на (от англ. ubiquitous — вездесущий), экспрессируемого во всех клетках эукариот. Присоединение осуществляется через образование изопептидной связи между С-концевым глицином убиквитина и лизиновым остатком белка-мишени (рис. 34).
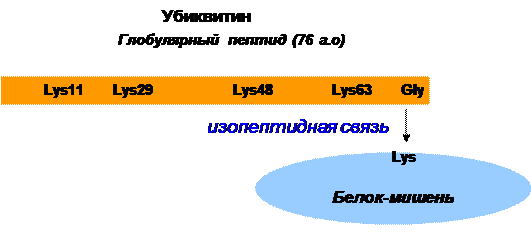
Рис. 34. Схематичное представление присоединения молекулы
убиквитина к белку-мишени
О существовании такой посттрансляционной модификации самых различных белков было известно давно, но функциональное значение ее несколько десятилетий оставалось неясным. В 2004 г многолетние исследования Аарона Чехановера, Аврама Гершко и Ирвина Роуза были удостоены Нобелевской премии по химии «за открытие убиквитин-опосредованной деградации белка». Они показали, что белки, «меченые» пришитыми к ним длинными цепочками из убиквитина, узнаются цитоплазматическими 26S- протеасомами. Таким образом, убиквитинирование стало восприниматься как «метка смерти» для цитоплазматических белков. В отличие от лизосом, с помощью протеасом уровень белков в цитоплазме можно изменять очень быстро. Дальнейшие исследования показали, что убиквитинирование вовлечено в такие важные процессы, как регуляция пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК, избавление от неправильно свернутых или дефектных вновь синтезированных белков.
Однако далеко не все эти процессы связаны с деградацией убиквитинированных белков в протеасомах. Оказалось что многие трансмембранные белки, в частности рецепторные, дергадируют в лизосомах, но при этом подвергаются убиквитинированию. Довольно долго было неясно, как разрешить это протворечие.
7.1. ТИПЫУБИКВИТИНИРОВАНИЯ: МОНО-,
МУЛЬТИ- И ПОЛИУБИКВИТИНИРОВАНИЕ
Поскольку сам убиквитин имеет в своем составе несколько остатков лизина (в 11, 29, 48 и 63 положениях), он также может быть мишенью убиквитинирования. В результате могут получаться цепи, связанные через разные остатки лизина и содержащие различное количество молекул убиквитина. Также выяснилось, что убиквитин и/или убиквитиновые цепи способны по-разному присоединяться к белкам–мишеням.
Так, к лизину белка-мишени может присоединяться одна молекула убиквитина. Такой тип модификации называется моноубиквитинированием. О полиубиквитинировании говорят, если к одному или нескольким лизинам белка-мишени присоединены длинные убиквитиновые цепочки, причем длина может быть различной. Первоначально считали, что полиубиквитинирование является универсальным типом модифицирования белков, однако впоследствии было выяснено, что существует еще и смешанный тип модификации, когда к множественным лизинам белка присоединяются как единичные молекулы убиквитина, так и цепочки. Такой тип чаще всего называют мультиубиквитинированием. Поскольку основным способом детекции убиквитинированных белков первоначально был одномерный электрофорез с последующим иммуноблоттингом, то различить мульти- и полиубиквитинирование было практически невозможно, поскольку в обоих случаях разнообразные убиквитинированные формы белка выявлялись как длинная слошная зона выше немодифицированного белка. По-английски ее вид часто характеризуется как «slurry» (жидкая грязь, кашица). Такой поведение модифицированного белка при электорфорезе говорит о том, что мишени, как правило, модифицируются множеством цепочек разной длины одновременно.
Применение масс-спектрометрии в комбинации с генно-инженерными подходами позволило выявить дальнейшие детали. Оказалось, что важен не только тип модификации, но и то, через какой остаток лизина формируется убиквитиновая цепочка. Так, в качестве сигнала протеасомной деградации воспринимаются убиквитиновые цепочки не менее чем из 8-ми молекул, соединенных через Lys48 убиквитина. Именно такие цепочки участвуют в полиубиквитинировании. Гораздо более обширными функциями обладают цепочки, образованные через Lys63. Модифицированные ими белки участвуют в процессах репарации ДНК, трансляции, активации сигнальных белков (например, активации киназы IkappaB) и, что наиболее существенно в рамках нашей темы, в регуляции эндоцитоза. Цепочки, присоединяемые к белку при мультиубиквитинировании, как правило, содержат до 4 молекул убиквитина, связанных именно через Lys63. Таким образом, тип цепи определяет реакции, в которых участвует убиквитинированный белок.
Моноубиквитинирование, как правило, работает как негативный регулятор активности белков или их взаимодействий, хотя существуют и другие данные. В общем, можно утверждать, что на сегодняшний день регуляторные функции убиквитинирования еще далеки от полной расшифровки.
7.2. УБИКВИТИН-КОНЪЮГИРУЮЩАЯ СИСТЕМА. ДЕУБИКВИТИНИРОВАНИЕ.
УБИКВИТИН-УЗНАЮЩИЕ ДОМЕНЫ
Внутриклеточные макромолекулы, как известно, подвергаются множеству ковалентных модификаций. Фосфорилирование, метилирование и др. играют важную роль в регуляции внутриклеточных процессов. Как правило, модифицированный статус той или иной макромолекулы поддерживается благодаря системам из пары ферментов, один из которых присоединяет определенную группу к молекуле, а другой – отрезает. Таковы, например, системы протеинкиназ и фосфатаз, ацетилтрансфераз и деацетилаз. Убиквитин-конъюгирующая система устроена гораздо сложнее и работает по каскадному принципу. Она состоит из так называемых ферментов Е1 (убиквитин-активирующий фермент, или Uba), E2 (убиквитин-конъюгирующий фермент, или Ubc) и Е3 (убиквитин-лигаза, или Ubl). Первоначально считалось, что система эта построена по принципу пирамиды: количество изоформ ферментов подчиняется правилу Е1 < E2 < E3. Предполагали, что первые стадии, общие для всех конечных субстратов, не нуждаются в специфичности, и поэтому могут опосредоваться в принципе одним и тем же ферментом Е1, а специфичность взаимодействия с субстратом обеспечивают Е2 и в большей степени Е3. Однако к настоящему времени идентифицировано множество вариантов Е1, как канонических, так и неканонических, и все больше распространяется представление, в соответствии с которым вся цепочка из трех ферментов может иметь достаточно высокую специфичность по отношению к белку-мишени.
Реакция убиквитинирования проходит в несколько стадий. На первой Е1 связывает MgАТФ и свободный убиквитин. За счет гидролиза АТФ формируется тиоэфирная связь между Е1 и карбоксильным концом убиквитина. На второй стадии Е1 передает связанный убиквитин на SH-группу Е2 также с образованием тиоэфирной связи. На третьей стадии Е2-убиквитин образует комплекс с убиквитин-лигазой Е3, с которой уже связан белок-мишень. Заключительная стадия сводится к переносу убиквитина с Е2 на лизиновый остаток мишени. Считается, что повторение 3 и 4 стадий приводит к росту убиквитиновой цепи, хотя есть предположения и о существовании специального фактора элонгации Е4, функция которого как раз и состоит в удлинении цепочек. Остается также неясным, каким образом регулируется выбор лизина для присоединения убиквитина, в том числе и к нескольким различным лизинам мишени при поли- и мультубиквитинировании
Убиквитин-лигазы делятся на два больших семейства. Это ферменты ЕЗ, содержащие каталитический RING домен (Really Interesting New Gene), и НЕСТ-доменные ЕЗ лигазы (Homologous to E6-associated protein C-Terminus).
Функция RING-доменных убиквитин-лигаз заключается в координации взаимного положения белка-мишени и Е2-убиквитин-тиоэфирного комплекса таким образом, чтобы обеспечить прямую передачу убиквитина от Е2 к белку. В эту группу входят как мономерные белки (например, с-Cbl), так и многокомпонентные белковые комплексы, например, куллин-содержащие убиквитинлигазные комплексы (SCF-комплексы), для которых каждая из молекулярных функций обеспечивается специфической субъединицей. Таким образом, группа эта весьма неоднородна.
Напротив, все НЕСТ-доменные ЕЗ лигазы - мономерные белки с относительно простой структурной организацией. В отличие от RING-доменных убиквитин-лигаз, при взаимодействии между Е2 и НЕСТ-доменной ЕЗ происходит перенос молекулы убиквитина сначала на остаток цистеина активного центра домена НЕСТ. После этого ЕЗ НЕСТ-убиквитин взаимодействует с белком-мишенью, и передает на него убиквитин.
Вне зависимости от степени сложности структурной организации убиквитин-лигаз, как RING-, так и HECT-доменных, многие из них полифункциональны. Это свойство поддерживается наличием ряда доменов, не участвующих в реакции убиквитинирования.
Кроме Е1-Е3 белков, в систему убиквитинирования входят так называемые DUBs, или деубиквитинирующие белки, отщепляющие убиквитин от белков-мишеней и возвращающие его в пул свободного внутриклеточного убиквитина. Существует DUB-активность, ассоциированная с протеасомами, и деубиквитинирование белка необходимо для последующего его протеасомного гидролиза. Известны также несколько деубиквитинирующих ферментов, не связанных с протеасомами. В результате совместного действия Е1-Е3 ферментов и DUBs состояние убиквитинирования конкретного белка может быть весьма лабильным, транзиторным, и набор модифицированных лизинов, как и длина цепочек (то есть то, что можно назвать «профилем убиквитинирования»), способны очень быстро изменяться. Это делает механизм убиквитинирования тонко настраиваемой системой мечения белков с широкими функциями.
Если система убиквитинирования (по крайней мере, отчасти) направлена на мечение белков, то должны существовать ответные механизмы распознавания этой метки. Действительно, многие белки содержат так называемые UBD-домены (ubiquitin-binding domains), различающиеся по структуре и сродству к цепочкам разной длины или участкам связи между соседними убиквитинами в цепочке. По-видимому, разнообразие таких доменов достаточно велико. В некоторых белках обнаружены кластеры UBD. Интересно, что убиквитин-узнающие домены не только обеспечивают специфичность взаимодействия убиквитинированного белка с его партнерами в ходе какого-либо процесса, но и способны защищать его от протеасомной деградации. Кроме того, UBD могут участвовать в регуляции активности белков: в случае, если такой домен локализован в непосредственной близости от активного центра или свзязывающего домена белка, ассоциация его с убиквитином может работать как чисто механическое препятствие его взаимодействия с субстратом. Таким образом, убиквитинирование может выступать и в качестве негативного регулятора определенных взаимодействий.
7.3. УБИКВИТИНИРОВАНИЕ И РЕГУЛЯЦИЯ ЭНДОЦИТОЗА. УБИКВИТИНИРОВАНИЕ
БЕЛКОВ-ГРУЗОВ И РЕГУЛЯТОРНЫХ БЕЛКОВ
Как упоминалось выше, модификация убиквитином многих белков была известна уже давно, однако ее функциональное значение оставалось неясным. Открытие убиквитин-зависимого механизма деградации белков многое объяснило, но в то же время вызвало многочисленные вопросы. Так, оказалось, что убиквитиниррованию подвергаются не только цитоплазматические белки, но и многие белки, локализованные в плазматической мембране, в том числе компоненты некоторых ионных каналов, транспортеров, рецепторы Т-клеток, некоторые рецепторы, сопряженные с G-белками, рецепторные тирозинкиназы и ряд других. Смущало также то, что хотя характер окрашивания антиубиквитиновыми антителами модифицированного рецептора ЭФР или ФРВТ на электорфорезе был неотличим от характера окрашивания любых других полиубиквитинированных белков, деградация этих рецепторов в лизосомах была надежно установлена и задокументирована, хотя полиубиквитинирование рассматривалось именно как сигнал протеасомной деградации.
Дальнейшие исследования показали, что убиквитинирование рецепторных белков не имеет прямого отношения к протеасомам, а связана с регуляцией эндоцитозного пути (рис. 35). Выяснилось, что белки-грузы, как правило, не поли-, а мультубиквитинированы.
Самым изученным с этой точки зрения является рецептор ЭФР. Известно, что основные остатки лизинов, по которым проходит
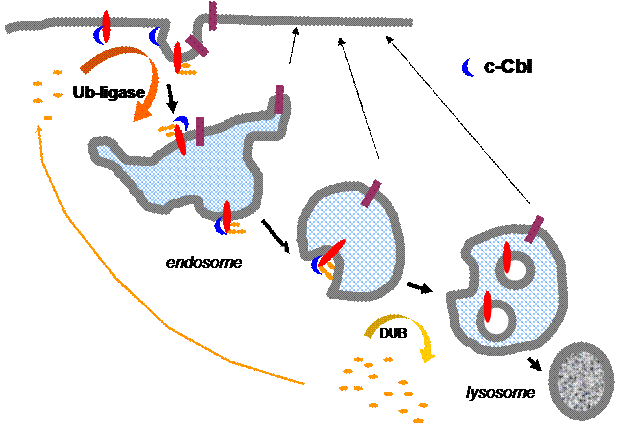
Рис. 35. Мультиубиквитинирование мембранного белка
необходимо для доставки его во внутренние везикулы МВТ,
что ведет к его деградации в лизосомах, тогда как
неубиквитинируемый рецептор остается во внешней
мембране и рециклирует
модификация, локализуются в области тирозинкиназного домена, не затрагивая С-терминальной регуляторной области. Большинство рецепторных тирозинкиназ убиквитинируется RING-доменной убиквитин-лигазой с-Cbl и ее изоформами, связывающейся с определенным фосфорилированным тирозиновым остатком рецептора после активации последнего. Известно, что по мере созревания эндосом направляемый на деградацию груз поочередно взаимодействует с четырьмя сортирующими комплексами ESCRT0-III ( E ndosomal s orting c omplex r equired for t ransport). Нарушение этого взаимодействия блокирует как созревание эндосом, так и сортировку груза на путь деградации. Оказалось, что определенные компоненты этих комплексов обладают UBD-доменами, что обеспечивает их взаимодействие с убиквитинированным грузом. Убиквитин-узнающие домены сортирующих комплексов принадлежат к разным типам - UBA, UIM и UEV, что может означать избирательное сродство конкретного комплекса к определенному профилю убиквитинирования груза. Изменение профиля убиквитинирования обеспечивается, с одной стороны, постоянной работой ассоциированной с активированным рецептором убиквитин-лигазы с-Cbl, а с другой стороны – активностью деубиквитинирующих ферментов. Два таких фермента, – AMSH и UBPY, – были идентифицированы на эндосомах. Возможно, что изменение профиля убиквитинирования рецептора позволяет координировать работу комплексов, однако это предположение еще нуждается в доказательствах.
Как полагают, основная функция сортирующих комплексов связана с концентрированием убиквитинированных грузов в областях мембраны эндосомы, из которых затем будут формироваться внутренние пузырьки МВЭ. Непосредственно перед попаданием в пузырек рецептор деубиквитинируется, а убиквитин вновь включается в оборот. Таким образом, мультубиквитинирование мембранных белков может рассматриваться как сигнал доставки грузов во внутренние пузырьки мультивезикулярных тел.
Моноубиквитинирование также связано с регуляцией эндоцитозного пути. Во-первых, есть данные о том, что для рекрутирования рецептора в окаймленную ямку достаточно присоединения к нему одной молекулы убиквитина, однако это продемонстрировано лишь на модельных ситемах. Во-вторых, моноубиквитинированию (по всей видимости, с-Cbl-зависимому) подвергаются некоторые вспомогательные белки и компоненты сортирующих комплексов, что приводит к их «выключению» (рис. 36). Так, заякоривание рецептора ЭФР в области окаймленной ямки обеспечивает его взаимодействие с комплексом Eps15/epsin, взаимодействующим с С-терминальным регуляторным доменом
. 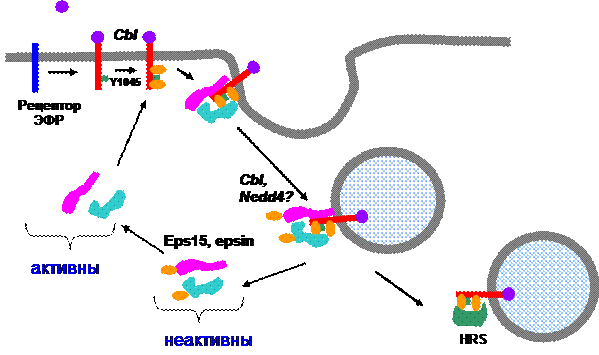
Рис. 36. Моноубиквитинирование вспомогательных белков
осуществляет их регуляцию по механизму обратной связи
рецептора. После формирования и отщепления ОЯ эти белки моноубиквитинируются, в результате чего теряют активность, и уходят в цитоплазму, освобождая интернализованный рецептор для новых взаимодействий. Таким образом, моноубиквитинирование здесь выступает как механизм негативной регуляции молекулярных взаимодействий.
Как упоминалось выше, убиквитин-лигазы, как правило, полифункциональны. Основная убиквитинлигаза эндоцитозного пути, c-Cbl, является ярким тому примером (рис. 37). Ее N-терминальный участок содержит так называемый TKB ( t yrosine k inase b inding) домен, обеспечивающий прямое взаимодействие с фосфорилированными по тирозину рецепторами-мишенями. Далее следует короткий линкерный участок и RING-домен, отвечающий за взаимодействие с Е2, т. е. за реакцию убиквитинирования как таковую. С этим же участком может связываться белок Sprouty, блокирующий убиквитинирование. К связанным с убиквитином процессам относится также UBA-домен, локализованный непосредственно на С-конце молекулы.

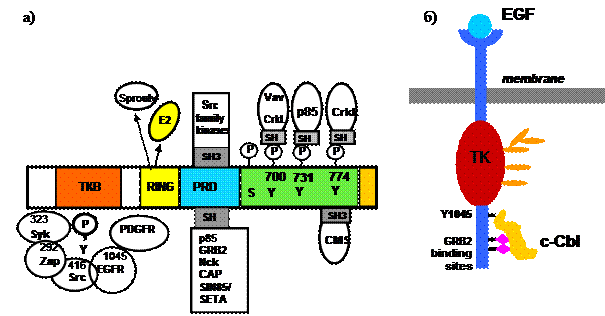
Рис. 37. Доменная организация убиквитин-лигазы с-Cbl.
На схеме представлены: (a) – белки, взаимодействующие с
различными доменами с-Cbl. б – рецептор ЭФР связывается
с с-Cbl с помощью трех сайтов, а убиквитинированию
подвергаются остатки лизина в ТК-домене рецептора
Чуть больше половины белка занимают домены, отвечающие за белок-белковые взаимодействия по механизму, опосредуемому SH3- и SH2–доменами – PRD-домены и многочисленные сайты тирозинового фосфорилирования, из которых три мажорных.
Одного взгляда на список партнеров с-Cbl достаточно, чтобы представить, в каких разных процессах этот белок участвует. Тут и адаптерные белки, и киназы Src-семейства, и PI3-киназа p85. Интересно, что как р85, так и Src-киназа может связываться с с-Cbl двумя разными способами. Рецептор ЭФР имеет три сайта, один из которых, фосфотирозин Y1045, взаимодействует с с-Cbl через ее ТКВ-домен, а два дополнительных, Y1068 и Y1101 – через регуляторный С-терминальный домен убиквитин-лигазы. Связывание через Y1045 является необходимым для убиквитинирования рецептора и его лизосомной деградации. Функции же двух других сайтов неясны.
Недавно появились данные об ассоциации с-Cbl с микро-трубочками, а также о способности убиквитин-лигазы конкурентно вытеснять деацетиалазу HDAC6, поддерживающую динамичность плюс-конца микротрубочек, с одного и того же связывающего сайта рецептора ЭФР.
До сих пор неясно, как связана работа c-Cbl в качестве убиквитин-лигазы и в качестве адаптера, но очевидно, что участие во многих взаимодействиях расширяет возможности ее регуляции.
7.4. УБИКВИТИН-ПОДОБНЫЕ БЕЛКИ,
ИХ РОЛЬ В ТРАНСПОРТНЫХ ПРОЦЕССАХ.
СВЯЗЬ УБИКВИТИН-ЗАВИСИМЫХ МЕХАНИЗМОВ СОРТИРОВКИ БЕЛКОВ С НАПРАВЛЕНИЕМ ИНВАГИНАЦИИ МЕМБРАНЫ
Кроме убиквитина, в клетках млекопитающих к настоящему моменту идентифицировано около 10 так называемых убиквитин-подобных белков (ubiquitin-like proteins, UBL), присоединение которых к мишеням приводит к различным эффектам. Представителями этого быстро растущего семейства являются SUMO, Nedd8, ISG15 и Atg8. Несмотря на отсутствие гомологии в последовательностях разных UBL, принцип их работы схож. Их присоединение к мишеням также опосредуют системы ферментов Е1-Е3, хотя и здесь гомология с компонентами убиквитинирующего каскада практически отсутствует. Исследования функций UBL и механизмов их регуляции еще далеки от завершения.
Среди всех UBL в рамках нашей темы наибольший интерес представляют убиквитин-подобные белки семейства Atg8 (autophagy-related proteins), связанные с формированием аутофагосом. Выделяют несколько типов аутофагии, один из них - макроаутофагия – процесс заключения в двойную мембрану части цитоплазмы клетки с содержащимися в ней агрегатами белков или органеллами и последующая деградация содержимого в лизосомах. Аутофагия стимулируется при действии на клетку различных стрессорных факторов, например, голодания, и развивается в течение нескольких часов. До сих пор идут споры о происхождении аутофагосомной мембраны, и пальму первенства держат мембраны аппарата Гольджи и ранние эндосомы. Для формирования мембраны аутофагосомы необходима конъюгация убиквитин-подобного белка LC3B (microtubule associated protein 1 light chain 3), гомолога дрожжевого Atg8, экспрессирующегося в клетках млекопитающих, с липидом фосфатидилэтаноламином, локализованным в мембране предшественника (фагофора) аутофагосомы. Эта реакция осуществляется по каскадному приципу с участием Atg7 (E1-подобная активность), Atg 3 (E2) и Atg12-Atg5-Atg16L (Е3–лигазная активность). В аутофагосоме LC3 в связанном виде (LC3II) участвует в селекции груза для деградации, а также, возможно, в заякоривании и слиянии мембран аутофагосомы с лизосомами или другими органеллами.
Убиквитин-зависимые механизмы, по всей видимости, вовлечены также в образование «in-out» инвагинаций, поскольку компоненты той же системы, которая обеспечивает формирование внутренних пузырьков МВТ, участвуют в сборке вирусных частиц на плазматической мембране. Так, показано, что для упаковки вирусов HIV-1 необходимо присутствие белка TSG101, компонента сортирующего комплекса ESCRT-I. Формирование аутофагосомы с двойной мембраной также напоминает формирование внутреннего пузырька МВЭ, в случае, когда этот «пузырек» имеет площадь, равную приблизительно половине площади исходной мембраны.
7.5. УБИКВИТИНИРОВАНИЕ. ЗАКЛЮЧЕНИЕ
Исследование семейства убиквитин-зависимых систем в настоящее время является «горячей точкой» клеточной биологии. Не все компоненты системы идентифицированы, далеки от понимания механизмы ее функционирования, крайне разнообразны уже известные функции. С учетом убиквитин-подобных белков эта модификация оказывается даже более распространенной в клетках эукариот, чем фосфорилирование. Тем не менее, можно говорить о том, что поли- и мультиубиквитинирование действительно в конечном итоге является «меткой смерти» для модифицированного белка, в первом случае – в протеасомах, а во втором – в лизосомах. К настоящему моменту нельзя утверждать, что убиквитинирование – это единственный способ для белка-груза попасть в лизосомы: в дрожжах найдены несколько белков, которые деградируют в лизосомах, не подвергаясь предварительно убиквитинировованию. Тем не менее, список белков и белковых комплексов, использующих убиквитин-зависимый путь доставки в лизосомы, увеличивается с каждым днем, и появляется все больше данных о сложных взаимоотношениях внутри убиквитин-подобного семейства в целом.
8. АДФ-РИБОЗИЛИРОВАНИЕ
Еще одной посттрансляционной модификацией является присоединение к макромолекулам остатка АДФ-рибозы или ее цепочек, добавление и удаление которых осуществляется соответствующими ферментами, а источником является NAD+. Субстраты АДФ-рибозилирования весьма многочисленны, а его эффект неоднозначен. Так, АДФ-рибозилирование тримерного ГТФ-связывающего белка Gс холерным токсином угнетает активность его ГТФазы, стабилизируя Gс в его активном состоянии, стимулируя аденилатциклазу и тем самым увеличивая синтез циклического АМФ. В противоположность этому АДФ-рибозилирование Gi коклюшным токсином стабилизирует Gi в связанном с ГДФ неактивном состоянии; в результате этого коклюшный токсин предотвращает гормональное угнетение аденилатциклазы. В общем случае можно говорить о том, что АДФ-рибозилирование модулирует активность различных ферментов.
Целый ряд токсинов стимулирует АДФ-рибозилирование различных мишеней, что и опосредует токсический эффект. Вовлечение этой модификации в регуляцию везикулярного транспорта имеет несколько аспектов. Во-первых, такой важный регулятор везикулярного транспорта, инициирующий формирование нескольких типов окаймлений, как малая ГТФаза ARF1 (ADP-ribosylation factor1) была первоначально идентифицирована как ко-фактор АДФ-рибозилтрансферазы холерного токсина. Именно этот факт отражен в названии малой ГТФазы, и лишь впоследствии выяснилась ее роль в регуляции везикулярного транспорта в норме.
Во-вторых, важность АДФ-рибозилирования стала ясна после того, как в конце 1980 гг. было продемонстрировано действие макролидного лактона Брефельдина А (BFA) на динамику мембран компартментов биосинтетического пути. Действительно, эффект оказался весьма драматическим и очень зрелищным: буквально через несколько минут после добавления к клеткам этого антибиотика начинается интенсивная тубуляция мембран аппарата Гольджи в направлении клеточной периферии, завершающаяся быстрым слиянием с мембранами ЭПР и полным растворением в них (рис. 38).
 |
Рис. 38. Брефельдин А вызывает тубуляцию мембран
Гольджи по направлению к ЭПР и полное смешение
мембран двух компартментов
Естественно, встал вопрос о механизмах такой реорганизации. В первых работах с BFA обнаружили, что он блокирует ARF1 в ГДФ-связанной форме, и препятствует тем самым сборке СОРI-окаймления. Однако, это должно было бы препятствовать возвратному транспорту мембран АГ в ЭПР, эксперименты же показывают скорее противоположный эффект. Тогда было сделано предположение, что роль окаймления (по крайней мере, СОРI) заключается, в частности, в препятствовании неконтролируемой тубуляции мембран.
Дальнейшие исследования, однако, привели к отказу от этой гипотезы. Так, обнаружили, что эндосомы и транс-Гольджи в присутствии BFA не тубулируются, а коллапсируют в области ЦОМТ, в то время как лизосомы медленно (в течение часов) тубулируются. Парадокс заключался в том, что на лизосомах нет ни ARF1, ни COPI. Кроме того, была обнаружена линия клеток Ptk1, в которых аппарат Гольджи не разбирается в ответ на добавление BFA, хотя COPI снимается с мембран. Следовательно, поведение ARF1 и COPI не являются причиной эффекта BFA.
Оказалось, что в клетках, истощенных по NAD+ (источнику АДФ-рибозы), ARF1 и COPI уходят с мембран при действии BFA, а Гольджи остается интактным. Таким образом, причина тубуляции мембран кроется в АДФ-рибозилировании неких мишеней, препятствующих тубуляции. Было обнаружено, что BFA стимулирует АДФ-рибозилирование двух белков – BARS50 и глицерофосфат-дегидрогеназы GAPDH.
О конкретных механизмах участия этих двух белков в регуляции тубуляции известно немного. Последние исследования показали, что CtBP1-S/BARS локализован на тубулярных мостиках, связывающих стопки цистерн аппарата Гольджи в единую ленту, и способен ацилировать лизофосфатидную кислоту LPA, т. е. модифицировать мембранные липиды. Интересно, что этот белок участвует также во фрагментации АГ перед митозом, и его нокаут блокирует вход в митоз. Эффект ингибитора АДФ-рибозилирования дикумарина (dicumarol), вызывающего селективное разрушение тубулярных компонентов аппарата Гольжди и ингибирование транспорта, зависит от активности BARS, при этом искусственное пре-АДФ-рибозилирование цитозоля препятствует разрушению тубул Гольджи дикумарином. Все это свидетельствует о достаточно сложном механизме действия BARS, который может как поддерживать тубуляцию в строго определенных участках мембраны, так и обеспечивать ee фрагментацию (fission) в строго определенный момент, тогда как при нарушении нормальной регуляции этих функций в результате АДФ-рибозилирования тубуляция принимает неконтролируемый характер.
В связи с общими механизмами тубуляции мембран представляется существенной способность BARS модифицировать липиды. То, что липиды участвуют в этом процессе, несомненно, также как и то, что они работают под контролем различных сигналов. В пользу этого свидетельствует то, что в присутствии вортманнина, ингибитора PI-3 киназ I- и III-го классов, происходит тубуляция рециклирующих эндосом, тогда как организация мембран аппарата Гольджи не нарушается (рис. 32, б).
Идентификация глицерофосфатдегидрогеназы GAPDH в качестве мишени BFA несколько неожиданна, поскольку этот белок рассматривался как классичесикий гликолитический фермент. Однако последние данные говорят в пользу его мультифункциональности и наличии активностей, отличных от метаболической. Эти активности могут регулироваться как локализацией GADPH, так и его модификациям. Например, этот фермент способен взаимодействовать с микротрубочками, обеспечивая связь между Rab2 и динеином. Хотя BFA приводит к перераспределению мембран АГ и в отсутствие микротрубочек, в норме тубулирующаяся мембрана «опирается» на МТ. Так происходит и с тубулярными участками ЭПР.
9. РОЛЬ ЦИТОСКЕЛЕТА
В ПОЗИЦИОНИРОВАНИИ ОРГАНЕЛЛ И ТРАНСПОРТНЫХ ПРОЦЕССАХ
9.1. ТИПЫЦИТОСКЕЛЕТА, ИХ ОСНОВНЫЕ
СВОЙСТВА
Как известно, поддержание формы клетки, способность изменять ее при действии различных внешних факторов, в том числе механических, клеточная подвижность и клеточное деление обеспечивается цитоскелетом. Состоя из длинных белковых полимеров, цитоскеле́т фактически является очень динамичным внутриклеточным каркасом. Он важен также для позиционирования (поддержания взаимного расположения) органелл и везикулярного транспорта.
Выделяют несколько основных типов цитоскелета. Это полимеры актина, состоящие из двух спирально скрученных цепочек, которые образуют микрофиламенты диаметром 7 нм; они формируют кортикальный (подмембранный) цитоскелет, стресс-фибриллы и фибриллы растущего края (ламеллиподии). Второй тип представлен микротрубочками – полыми цилиндрами диаметром 20 нм, образованными параллельно лежащими протофиламентами, состоящими из димеров альфа- и бета-тубулина, выстроенных по принципу «голова к хвосту». Промежуточные филаменты могут образовываться разными белками (виментиновые, кератиновые и т. д.) и имеют диаметр в среднем около 13 нм, за что и получили свое название. Также к цитоскелету можно отнести сети из белка спектрина, способного взаимодействавать с другими типами цитоскелета и мембранами компартментов. Спектриновая сеть подстилает плазматическую мембрану, придавая ей большую механическую прочность, и окружает фактически все органеллы – эндосомы, аппарат Гольжди и т. д., ко