Лабораторная работа № 3.5 (18)
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ  ВОЗДУХА
ВОЗДУХА
Цель работы: изучение первого закона термодинамики и теории теплоемкости идеального газа; измерение 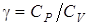 воздуха.
воздуха.
ТЕОРЕТИЧЕСКИЙ МИНИМУМ
Первый закон термодинамики
Количество теплоты  , сообщенное системе, расходуется на приращение внутренней энергии
, сообщенное системе, расходуется на приращение внутренней энергии  системы и на совершение ею работы
системы и на совершение ею работы  против внешних сил
против внешних сил
 . (1)
. (1)
Соотношение (1) является частной формой закона сохранения энергии применительно к тепловым (термодинамическим) процессам.
Теплоемкость
Теплоемкостью тела называется физическая величина, численно равная количеству теплоты, которое надо сообщить телу, чтобы повысить его температуру на один градус. Если сообщение телу количества теплоты  повышает его температуру на
повышает его температуру на  , то теплоемкость
, то теплоемкость  тела по определению равна
тела по определению равна
 . (2)
. (2)
Удельной теплоемкостью  называется теплоемкость единицы массы вещества. Справедливо равенство
называется теплоемкость единицы массы вещества. Справедливо равенство  , где
, где  – масса тела.
– масса тела.
Молярной теплоемкостью  называется теплоемкость одного моля вещества
называется теплоемкость одного моля вещества  , где
, где  – молярная масса (масса моля).
– молярная масса (масса моля).
Теплоемкость идеального газа[1] зависит от условий, при которых происходит нагревание газа. Если газ нагревается при постоянном объеме (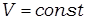 ), то это теплоемкость при постоянном объеме и обозначается
), то это теплоемкость при постоянном объеме и обозначается  (молярная теплоемкость
(молярная теплоемкость  ). Если газ нагревается при постоянном давлении (
). Если газ нагревается при постоянном давлении ( ), то это теплоемкость при постоянном давлении и обозначается
), то это теплоемкость при постоянном давлении и обозначается  (молярная теплоемкость
(молярная теплоемкость  ).
).
Молярные теплоемкости  и
и  связаны уравнением Майера
связаны уравнением Майера
 , (3)
, (3)
где 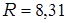 Дж/(мольּК) – универсальная газовая постоянная.
Дж/(мольּК) – универсальная газовая постоянная.
При нагреве газа в жестком замкнутом сосуде (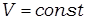 ) все передаваемое тепло, согласно (1), идет только на увеличение внутренней энергии газа:
) все передаваемое тепло, согласно (1), идет только на увеличение внутренней энергии газа:  . Нагревая тот же газ в сосуде с подвижным поршнем (
. Нагревая тот же газ в сосуде с подвижным поршнем ( ), будет наблюдаться не только увеличение температуры (или внутренней энергии) газа, но и его расширение, то есть совершение газом работы над внешними телами:
), будет наблюдаться не только увеличение температуры (или внутренней энергии) газа, но и его расширение, то есть совершение газом работы над внешними телами:  . Поэтому во втором случае нужно затратить большее количество теплоты, чтобы нагреть газ на один градус, то есть
. Поэтому во втором случае нужно затратить большее количество теплоты, чтобы нагреть газ на один градус, то есть  .
.
Для идеального газа согласно классической теории теплоемкостей
 , (4)
, (4)
где  – число степеней свободы молекулы газа.
– число степеней свободы молекулы газа.
Число степеней свободы
Число степеней свободы молекулы – это минимальное число координат, определяющих положение молекулы в пространстве. Для подсчета числа степеней свободы атомы в молекуле считают материальными точками. Если молекула одноатомная, то  (три координаты
(три координаты  ,
,  ,
,  ). Если молекула двухатомная и межатомное расстояние фиксировано[2], то
). Если молекула двухатомная и межатомное расстояние фиксировано[2], то  (три координаты
(три координаты  ,
,  ,
,  ) одного атома и два угла поворота (
) одного атома и два угла поворота ( ,
,  ) второго атома вокруг первого. «Жесткие» многоатомные молекулы аналогичны твердому телу, положение которого в пространстве описывается шестью координатами: три координаты (
) второго атома вокруг первого. «Жесткие» многоатомные молекулы аналогичны твердому телу, положение которого в пространстве описывается шестью координатами: три координаты ( ,
,  ,
,  ) центра масс молекулы и три угла поворота (
) центра масс молекулы и три угла поворота ( ,
,  ,
,  ) молекулы как целого вокруг центра масс, так что
) молекулы как целого вокруг центра масс, так что  . Для линейных многоатомных молекул (например, для СО2), у которых все атомы расположены вдоль одной линии, число степеней свободы
. Для линейных многоатомных молекул (например, для СО2), у которых все атомы расположены вдоль одной линии, число степеней свободы  .
.
Уравнение Клапейрона-Менделеева
Уравнение Клапейрона-Менделеева – это уравнение состояния идеального газа, которое имеет вид
 , (5)
, (5)
где 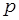 – давление газа,
– давление газа,  – объем,
– объем, 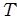 – абсолютная температура,
– абсолютная температура,  – масса,
– масса,  – молярная масса,
– молярная масса,  – универсальная газовая постоянная.
– универсальная газовая постоянная.
Изопроцессы
Изопроцессы – это термодинамические процессы, при которых один из параметров состояния ( ,
,  или
или 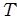 ) системы остается постоянным.
) системы остается постоянным.
Изотермический процесс – процесс при постоянной температуре. Для идеального газа из (5) получаем (при неизменной массе):  .
.
Изохорический процесс – процесс при постоянном объеме:  .
.
Изобарический процесс – процесс при постоянном давлении:  .
.
Адиабатический процесс
Адиабатическим процессом называется процесс, протекающий без теплообмена с окружающей средой.
Первый закон термодинамики для адиабатического процесса имеет вид:  , поскольку
, поскольку  . Это значит, что система может совершать работу над внешними телами за счет уменьшения своей внутренней энергии. Поэтому, например, охлаждается первоначально сжатый в баллоне газ при открывании баллона и резком уменьшении давления. За короткое время газ не успевает обменяться теплом с внешней средой (то есть процесс адиабатический), и работа по вытеснению газа совершается за счет внутренней энергии оставшегося в баллоне газа.
. Это значит, что система может совершать работу над внешними телами за счет уменьшения своей внутренней энергии. Поэтому, например, охлаждается первоначально сжатый в баллоне газ при открывании баллона и резком уменьшении давления. За короткое время газ не успевает обменяться теплом с внешней средой (то есть процесс адиабатический), и работа по вытеснению газа совершается за счет внутренней энергии оставшегося в баллоне газа.
Адиабатический процесс для идеального газа описывается уравнением Пуассона
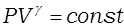 , (6)
, (6)
где  – показатель адиабаты. Учитывая (3) и (4), имеем
– показатель адиабаты. Учитывая (3) и (4), имеем

 . (7)
. (7)
МЕТОДИКА ЭКСПЕРИМЕНТА
Схема установки для определения величины 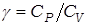 воздуха методом Клемана-Дезорма изображена на рис. 1.
воздуха методом Клемана-Дезорма изображена на рис. 1.
В стеклянный баллон Б насосом Н накачивается воздух. Если при накачивании воздуха давление в баллоне превышает некоторое максимальное значение  , то срабатывает водный ограничитель О, который сбрасывает лишнее давление воздуха. (Величина
, то срабатывает водный ограничитель О, который сбрасывает лишнее давление воздуха. (Величина  задается глубиной погружения трубки в воду в ограничителе.) С помощью манометра М измеряется разность давлений воздуха в баллоне и в атмосфере, которая пропорциональна разности уровней
задается глубиной погружения трубки в воду в ограничителе.) С помощью манометра М измеряется разность давлений воздуха в баллоне и в атмосфере, которая пропорциональна разности уровней  жидкости в манометре. Кран К позволяет соединять баллон с насосом, с атмосферой или перекрывать баллон.
жидкости в манометре. Кран К позволяет соединять баллон с насосом, с атмосферой или перекрывать баллон.
Рассмотрим сущность метода. Вначале открывается кран К и насосом в баллон накачивается воздух до некоторого давления и кран закрывается. Во время накачивания температура воздуха в баллоне несколько повышается. Через 2-3 минуты воздух в баллоне остывает, и его температура становится равной комнатной температуре. После установления термодинамического равновесия измеряется разность уровней 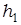 жидкости в манометре. При этом давление воздуха в баллоне
жидкости в манометре. При этом давление воздуха в баллоне
 , (8)
, (8)
где  – плотность жидкости в манометре (в нашем случае воды);
– плотность жидкости в манометре (в нашем случае воды);  – ускорение свободного падения;
– ускорение свободного падения; 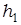 – разность уровней жидкости в манометре.
– разность уровней жидкости в манометре.
Затем на короткое время (на 1–2 секунды) открывается кран К и баллон соединяется с атмосферой. В результате давление воздуха в баллоне быстро понижается и выравнивается с атмосферным давлением. Это показывает манометр М: уровни жидкости в обоих коленах манометра выравниваются. Быстрое понижение давления воздуха в баллоне можно считать адиабатическим процессом, поэтому при расширении воздух в баллоне охлаждается. После закрывания крана наблюдается постепенное увеличение давления воздуха в баллоне за счет увеличения его температуры до комнатной. После установления термодинамического равновесия вновь измеряется разность уровней  жидкости в манометре. Располагая значениями
жидкости в манометре. Располагая значениями 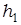 и
и  , можно рассчитать искомую величину отношения теплоемкостей
, можно рассчитать искомую величину отношения теплоемкостей 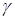 .
.
Анализ происходящих во время выполнения работы процессов удобно провести не для всей массы воздуха в баллоне, а для той его части, которая остаётся в баллоне после того, как часть воздуха выпущена во время адиабатического расширения. Так как к концу эксперимента оставшийся в баллоне воздух занимает весь объем баллона  , то до открывания крана эта масса газа занимала меньший объем
, то до открывания крана эта масса газа занимала меньший объем  . Таким образом, начальное состояние 1 рассматриваемой части газа характеризуется параметрами (
. Таким образом, начальное состояние 1 рассматриваемой части газа характеризуется параметрами ( ,
,  ,
,  ). Состояние 1 изображено прямоугольником 1 на схеме процесса (рис. 2) и точкой 1 на
). Состояние 1 изображено прямоугольником 1 на схеме процесса (рис. 2) и точкой 1 на  -диаграмме (рис. 3).
-диаграмме (рис. 3).
 |
 |
Соединение баллона с атмосферой приводит к быстрому расширению газа от объема
 до объема
до объема  . Давление в баллоне при этом падает от
. Давление в баллоне при этом падает от  до
до  . Рассматриваемый процесс можно считать адиабатическим, так как вследствие его кратковременности теплообмен между газом в баллоне и атмосферой не успевает произойти. При адиабатическом процессе работа по вытеснению газа совершается за счет внутренней энергии оставшегося в баллоне газа. Внутренняя энергия газа уменьшается, следовательно, уменьшается его температура от
. Рассматриваемый процесс можно считать адиабатическим, так как вследствие его кратковременности теплообмен между газом в баллоне и атмосферой не успевает произойти. При адиабатическом процессе работа по вытеснению газа совершается за счет внутренней энергии оставшегося в баллоне газа. Внутренняя энергия газа уменьшается, следовательно, уменьшается его температура от  до
до  .
.
Состояние 2 с параметрами (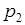 ,
, 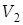 ,
,  ) изображено на рис. 2 и рис. 3 соответственно прямоугольником 2 и точкой 2. Переход между состояниями 1 и 2 описывается уравнением Пуассона для адиабатического процесса
) изображено на рис. 2 и рис. 3 соответственно прямоугольником 2 и точкой 2. Переход между состояниями 1 и 2 описывается уравнением Пуассона для адиабатического процесса
 . (9)
. (9)
После адиабатического расширения баллон перекрывается и оставшийся в нем газ изохорически (то есть при постоянном объеме  ) нагревается до комнатной температуры
) нагревается до комнатной температуры  . При этом давление газа в баллоне повышается до значения
. При этом давление газа в баллоне повышается до значения
 , (10)
, (10)
где  – установившаяся разность уровней жидкости в манометре после закрывания крана. Состояние 3 с параметрами (
– установившаяся разность уровней жидкости в манометре после закрывания крана. Состояние 3 с параметрами ( ,
,  ,
,  ) изображено на рис. 2 и на рис. 3 соответственно прямоугольником 3 и точкой 3.
) изображено на рис. 2 и на рис. 3 соответственно прямоугольником 3 и точкой 3.
Состояниям 1 и 3 соответствует одинаковая температура[3]:  . Следовательно, процесс перехода 1 ® 3 можно рассматривать как изотермический, для которого справедливо равенство
. Следовательно, процесс перехода 1 ® 3 можно рассматривать как изотермический, для которого справедливо равенство
 . (11)
. (11)
Подставив в уравнения (9) и (11) выражения (8) и (10), получим
 (12)
(12)
Точное решение системы (12) относительно величины  имеет вид
имеет вид
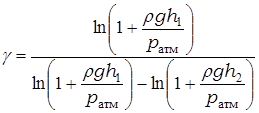 . (13)
. (13)
Поскольку в нашем эксперименте  , то, учитывая математическое соотношение:
, то, учитывая математическое соотношение:  при
при  , из формулы (13) находим расчетное выражение для отношения теплоемкостей
, из формулы (13) находим расчетное выражение для отношения теплоемкостей 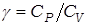
 . (14)
. (14)
Приборы и принадлежности: стеклянный баллон с краном и ограничителем давления; манометр; насос.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Налейте в ограничитель О (рис. 1) воду до уровня, заданного преподавателем или индивидуальным заданием.
2. Поворотом крана К (рис. 1) соедините баллон с насосом и накачайте воздух в баллон, насколько это позволит ограничитель О (пока не пойдут пузырьки из трубки ограничителя).
3. Закройте кран и подождите 2-3 минуты, пока уровни жидкости в манометре М перестанут изменяться. Сделайте отсчет разности уровней 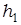 жидкости в манометре (рис. 1) и занесите результат измерений в табл. 1.
жидкости в манометре (рис. 1) и занесите результат измерений в табл. 1.
Таблица 1
| № |  , мм , мм
|  , мм , мм
| 
| 
| 
|
4. Придерживая кран К, выньте пробку крана, соединив баллон с атмосферой на 1-2 секунды, и затем верните пробку на место, вновь перекрыв баллон. (Пока открыт кран, давление воздуха в баллоне падает до атмосферного давления, и уровни жидкости в манометре выравниваются).
5. В течение последующих 2-3 минут после закрывания крана происходит увеличение разности уровней жидкости в манометре. Когда уровни в манометре перестанут изменяться, сделайте отсчет разности уровней  .
.
6. Опыты, описанные в пунктах 2-5, выполните еще четыре раза. Результаты измерений  и
и  занесите в табл. 1.
занесите в табл. 1.
7. Для каждого опыта по формуле (14) рассчитайте экспериментальные значения  и найдите среднее значение
и найдите среднее значение  . Полученные значения запишите в табл. 1.
. Полученные значения запишите в табл. 1.
8. Рассчитайте погрешность эксперимента по формуле
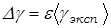 ,
,
где  ;
;  ,
,  .
.
Для определения абсолютной погрешности  найдите приборную погрешность манометра
найдите приборную погрешность манометра  (равна цене деления манометра) и случайную погрешность измерений
(равна цене деления манометра) и случайную погрешность измерений  . В качестве погрешности
. В качестве погрешности  выберите наибольшую из них. Погрешность
выберите наибольшую из них. Погрешность  определяется аналогично.
определяется аналогично.
Окончательный результат измерения отношения теплоемкостей запишите в виде доверительного интервала
 .
.
9. Воздух – это смесь в основном трех газов: азота  (78 % по объему), кислорода
(78 % по объему), кислорода  (21 %) и углекислого газа
(21 %) и углекислого газа  (0,03 %), молекулы которых имеют одинаковое число степеней свободы
(0,03 %), молекулы которых имеют одинаковое число степеней свободы  = 5 (смотрите с. 25). Учитывая это, по формуле (7) рассчитайте теоретическое значение
= 5 (смотрите с. 25). Учитывая это, по формуле (7) рассчитайте теоретическое значение  .
.
10. Сделайте вывод о совпадении теории с экспериментом, сопоставив теоретическое значение отношения теплоемкостей 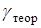 и экспериментальный доверительный интервал
и экспериментальный доверительный интервал  .
.
11. Рассчитайте, насколько уменьшается температура воздуха в баллоне в результате адиабатического расширения. Это можно сделать двумя способами, рассматривая адиабатический процесс 1 ® 2 или изохорический процесс 2 ® 3 (рис. 2). В первом случае необходимо использовать связь давления и температуры для адиабатического процесса:  . Во втором случае – уравнение изохорического процесса:
. Во втором случае – уравнение изохорического процесса:  . Записывая параметры данных равенств согласно рис. 2, получаем для адиабатического процесса
. Записывая параметры данных равенств согласно рис. 2, получаем для адиабатического процесса
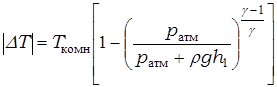 , (15)
, (15)
для изохорического процесса
 . (16)
. (16)
(Способ расчета изменения температуры  указывает преподаватель).
указывает преподаватель).
Комнатную температуру измерьте с помощью термометра в лаборатории и переведите полученный результат в абсолютную температуру. Атмосферное давление примите равным 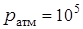 Па. Плотность манометрической жидкости (воды)
Па. Плотность манометрической жидкости (воды) 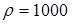 кг/м3;
кг/м3; 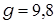 м/с2. В качестве величин
м/с2. В качестве величин  и
и  (в метрах) используйте результаты измерения, например, первого опыта. Значение
(в метрах) используйте результаты измерения, например, первого опыта. Значение  примите равным экспериментальному значению
примите равным экспериментальному значению  .
.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Сформулируйте первый закон термодинамики.
2. Что такое: a) теплоемкость тела; б) удельная теплоемкость; в) молярная теплоемкость?
3. Что такое: a) теплоемкость при постоянном объеме; б) теплоемкость при постоянном давлении? Какая из них больше и почему?
4. Что такое число степеней свободы молекулы? Чему равно число степеней свободы для молекул азота  , кислорода
, кислорода  , углекислого газа
, углекислого газа  ?
?
5. Что такое адиабатический процесс? Почему в данной работе процесс расширения газа при открывании крана можно считать адиабатическим?
6. Как и почему меняется температура газа при адиабатическом расширении?
7. Чему равен показатель адиабаты  в уравнении Пуассона (6)?
в уравнении Пуассона (6)?
8. Поясните, что характеризует объем  на рисунках 2 и 3.
на рисунках 2 и 3.
9. Поясните причину повышения давления в баллоне сразу после адиабатического расширения газа и закрывания крана.
Библиографический список
1. Трофимова Т.И. Курс физики. 2000. §§ 42, 50–55.
[1] Идеальным газом называется газ, молекулы которого не взаимодействуют между собой на расстоянии и суммарный объем молекул много меньше объема газа.
[2]При малых температурах колебаниями атомов в молекуле можно пренебречь.
[3] На рис. 3 точки 1 и 3 лежат на одной изотерме ().