Химия элементов
Р-элементы IIIA-подгруппы
B, Al, Ga
In, Tl – редкоземельные элементы
Характеристики р-элементов IIIA группы
| Элементы Характеристики | 5В | 13Al | 31Ga | 49In | 81Tl |
| Атомная масса | 10,81 | 26,98 | 69,72 | 114,82 | 204,37 |
| Валентные электроны | 2s22p1 | 3s23p1 | 4s24p1 | 5s25p1 | 6s26p1 |
| Металлический радиус атома, пм | |||||
| Ковалентный радиус атома, пм | − | ||||
| Условный радиус иона Э3+, пм | |||||
| Энергия ионизации | |||||
| Э0 → Э+, эВ | 8,3 | 5,98 | 6,00 | 5,78 | 6,10 |
| Э+ → Э2+, эВ | 25,15 | 18,8 | 20,5 | 18,9 | 20,4 |
| Э2+ → Э3+, эВ | 37,9 | 28,4 | 30,7 | 28,0 | 29,8 |
| Относительная электроотрицательность | 2,0 | 1,5 | 1,6 | 1,7 | 1,8 |
Элементы данной подгруппы могут проявлять степень окисления +3 и +1. Однако низшая степень окисления (+1) характерна в большей степени для таллия, тогда как +3 − для остальных элементов. Это объясняется тем, что от бора к таллию усиливаются металлические свойства элементов. В целом металлические свойства рассматриваемых элементов выражены слабее, чем у соответствующих элементов II группы, главной подгруппы
В − неметалл, полупроводник. Известен в аморфной (коричневой) и кристаллической (черной) формах.
Алюминий − серебристо-белый, мягкий металл. На воздухе алюминий покрывается тончайшей (~10−5 мм) плёнкой А12О3, имеющей большую прочность. Это делает его устойчивым при комнатной температуре к действию воды и некоторых других реагентов. По химическим свойствам алюминий − амфотерный элемент.
Таллий, индий, галлий − серебристо-белые, мягкие металлы. На воздухе они устойчивы, воду не разлагают, но легко растворяются в кислотах, а галлий и индий также и в щелочах.
Характерные свойства и важнейшие соединения
В обычных условиях бор инертен и непосредственно взаимодействует только со фтором (BF3).
При нагревании (400...700 °С) бор взаимодействует с кислородом (B2O3), серой (B2S3), хлором (BCl3) и даже азотом (при t > 1200 °С, BN).
На бор действуют лишь горячие концентрированные кислоты: азотная в серная, а также «царская водка» (3 НСl:1 HNО3), переводя его в Н3ВО3:
В + 3 HNО3(конц) → Н3ВО3 + 3 NО2.
Щёлочи, при отсутствии окислителей, на него не действуют. По химической активности аморфный бор более реакционно способен, чем кристаллический.
Непосредственно с водородом бор не взаимодействует.
В противоположность бору алюминий − химически активный металл.
Галлий, индий и таллий в периодической системе располагаются после d-элементов. Поэтому на их свойства влияет d-сжатие. Кроме того, на свойства таллия влияет дополнительно f-сжатие (уменьшение радиуса, и, как следствие, ослабление восстановительных свойств).
Подобно алюминию галлий и индий на воздухе покрываются прочной оксидной пленкой и поэтому практически не изменяются. Таллий же медленно окисляется. При накаливании Ga, In и особенно Tl энергично взаимодействуют с кислородом и серой. С хлором и бромом взаимодействуют при обычной температуре, с йодом − при нагревании.
| Me | Al | Ga | In | Tl (I) | Tl (III) |
| j°, В | −1,663 | −0,529 | −0,343 | +0,720 | −0,336 |
Галлий и индий растворяются в разбавленных кислотах с образованием ионов Ga3+ и In3+. Таллий при взаимодействии с кислотами образует соединения, в которых он проявляет степень окисления +1. В соляной кислоте он пассивируется за счет образования нерастворимого хлорида TlCl.
Галлий подобно алюминию растворяется в щелочах:
2 Ga + 6 NaOH + 6 H2O = 2 Na3[Ga(OH)6] + 3 H2.
Индий и особенно таллий в отсутствии сильных окислителей в щелочах не растворяются.
Кислотному оксиду В2О3 отвечает слабая ортоборная кислота  . При нейтрализации кислоты образуются метабораты, тетрабораты и соли других полиборных кислот:
. При нейтрализации кислоты образуются метабораты, тетрабораты и соли других полиборных кислот:
4 Н3ВО3 +2 NaOH = Na2B4O7 + 7 H2O.
(тетраборат натрия)
При нагревании ортоборная кислота дегидратирует до В2О3:

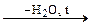

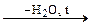 В2О3.
В2О3.
Оксид алюминия А12О3 проявляет амфотерные свойства, при обычных условиях для него в большей степени характерны основные свойства. Гидроксид алюминия амфотерен. Оксиды и гидроксиды галлия (III) и индия (III) амфотерны, гидроксид же таллия (III) обладает только основными свойствами. Соединения таллия (I) сходны и с соединениями щелочных металлов, и с соединениями серебра. Так, оксид таллия (I) Тl2О энергично соединяется с водой, образуя гидроксид Т1ОН − сильное хорошо растворимое основание. Галогениды таллия (I), за исключением T1F, подобно солям серебра, малорастворимые соединения и очень светочувствительны.
Алюминий и его соединения |
13Al0 − на внешнем энергетическом уровне в атоме алюминия находятся три валентных электрона:
нормальное состояние: 3s23p1 K = 1;
возбужденное состояние: 3s13p2 K* = 3
Наличие свободных р- и d-орбиталей представляет большие возможности для донорно-акцепторного взаимодействия. Реакционная активность алюминия обусловлена и менее прочной его кристаллической решеткой по сравнению с другими элементами группы.
Ион A13+, имея малый радиус и большой заряд, склонен к образованию комплексных соединений с координационными числами 6, реже − 4..
Оксид А12О3 обладает очень прочной кристаллической решеткой, известен в виде нескольких кристаллических модификаций (α, β, γ). Наиболее устойчива форма α- А12О3 (корунд). Все модификации А12О3 химически очень стойки, не взаимодействуют с водой и кислотами. При длительном нагревании реагируют с щелочами:
А12О3 + 2 NaOH = NaAlO2 + H2O.
С водородом алюминий непосредственно не реагирует.
Алюминий, являясь амфотерным элементом, реагирует и с растворами кислот, и щелочей. При взаимодействии с растворами кислот образуется катионный аквакомплекс состава [А1(Н2О)6]3+, который в упрощённом виде записывается как А13+:
2 A10 + 3 H2SO4(разб.) → A12(SO4)3 + 3 Н2;
2 А10 + 6 H+ = 2 Al3+ + 3 H2 или с учетом образования аквакомплекса
2 А10 + 6 Н3О+ + 6 Н2О → 2 [А1(Н2О)6]3+ + 3 Н2.
Разбавленная НNО3, концентрированные НNО3 и H2SO4 пассивируют алюминий. Коррозионную стойкость алюминия также можно повысить обработкой К2Сr2О7 или анодным окислением. Однако некоторые ионы (С1−) препятствуют образованию защитной плёнки, что ускоряет процесс его разрушения. Если с алюминия каким-либо способом снять защитную пленку, то он будет реагировать с водой:
2 А1 + 6 Н2О = 2 А1(ОН)3 + 3 Н2.
С растворами щелочей алюминий реагирует энергично, так как они растворяют защитную оксидную плёнку, образуя анионные комплексы:
2 Al + 6 NaOH + 6 H2O = 2 Na3[Al(OH)6] + 3 H2.
(гексагидроксоалюминат натрия)
Получаемый по обменной реакции гидроксид алюминия А1(ОН)3 − белый студенистый осадок:
A12(SO4)3 + 3 NaOH = А1(ОН)3 + 3 NaCl;
Al3+ + 3 ОН− = А1(ОН)3.
Действительный механизм его образования гораздо сложнее. Гидроксид-ионы щелочи постепенно вытесняют воду из аква-комплекса алюминия:
[А1(Н2О)6]3+ + ОН− → [А1(Н2О)5ОН]2+ + Н2О,
[А1(Н2О)5ОН]2+ + ОН− → [А1(Н2О)4(ОН)2]+ + Н2О;
[А1(Н2О)4(ОН)2]+ + ОН− → [А1(Н2О)3(ОН)3] + Н2О.

|
Одновременно происходит полимеризация с образованием многоядерных комплексов и в конечном итоге − выпадение осадка переменного состава А12О3∙nН2О. При стоянии осадок постепенно за счёт выделения воды переходит в А1(ОН)3(кр) и теряет свою активность − «стареет». При прокаливании А12О3∙nН2О полностью теряется вода и дегидратированный гидроксид − алюмогель является хорошим адсорбентом.
Гидроксид алюминия − типичное амфотерные соединение:
2 А1(ОН)3 + 3 Н2SO4 = A12(SO4)3 + 6 Н2О,
2 А1(ОН)3 + 6 Н+ = 2A13+ + 6 Н2О;
А1(ОН)3 + 3NaOH = Na3[Al(OH)6];
А1(ОН)3 + 3 ОН− = [А1(ОН)6]3−.
Кроме гексагидроксоалюминат-ионов могут образовываться тетрагидроксоалюминат ионы [А1(ОН)4]−, полиядерные комплексы [А12(ОН)2]4+. Таким образом, в зависимости от среды А1(ОН)3 образует либо катионные, либо анионные комплексы.
Безводные алюминаты можно получить нагреванием А12О3 или А1(ОН)3 с оксидами или гидроксидами металлов. При этом образуются как метаалюминаты (NaA1О2), так и различные полиалюминаты. Например, в системе СаО−А12О3 образуется пять соединений: 2СаО∙А12О3, 5СаО∙3А12О3, СаО∙А12О3, СаО∙2А12О3, СаО∙6А12О3.
Алюминаты щелочных металлов хорошо растворимы в воде. Они устойчивы только в сильнощелочной среде, в нейтральном растворе подвергаются практически полному гидролизу с образованием А1(ОН)3.
В растворах соли алюминия подвергаются гидролизу по схеме:
I. А13+ + Н2О ↔ А1ОН2+ + Н+,
II. А1ОН2+ + Н2О ↔ А1(OН)2+ + Н+.
На самом деле процесс протекает гораздо сложнее. Первой и второй стадией гидролиза является отщепление протонов водорода от молекул Н2О гидратного комплекса:
I. [А1(Н2О)6]3+ + Н2О → [А1(Н2О)5ОН]2+ + Н3О+,
II. [А1(Н2О)5ОН]2+ + Н2О → [А1(Н2О)4(ОН)2]+ + Н3О+.
Затем образуются различные полиядерные комплексы, которые остаются в растворе. Поэтому при растворении солей выпадение осадка гидроксида алюминия не наблюдается, хотя рН раствора меняется.
Соли алюминия, образованные очень слабыми кислотами, (сульфид, карбонат, цианид и др.) гидролизуются полностью. Так, сульфид алюминия Al2S3 гидролизуется полностью даже следами влаги в воздухе.
Соль A12(SO4)3∙18Н2О широко используется для очистки воды. Хлорид алюминия AlCl3 − хороший катализатор используется в технологии органических соединений (реакция Фриделя-Крафтса и др.). Алюмокалиевые квасцы (КA1(SO4)2∙12Н2О) применяются в кожевенной и текстильной промышленности. Алюмогидрид лития Li[AlH4] используют в органическом синтезе. Гексафтороалюминат натрия Na3[AlF6] применяется для получения алюминия, эмалей, стекла и пр. Металлический алюминий и его сплавы широко используют как конструкционные материалы. Восстановительные свойства алюминия применяют в алюмотермии.