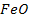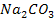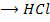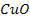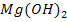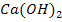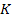Li, K, Ca, Na, Mg, Al, Zn, Fe, Sn, Pb, H, Cu, Hg, Ag, Au
Следует особо отметить, что из азотной кислоты ни один металл не вытесняет водород!
Азотная кислота реагирует практически со всеми металлами, кроме золота, но при этом образуются другие продукты реакции.
Контрольные задания III
Выписать из раздела II формулы приведенных в таблице 1 кислот, составить следующую таблицу и заполнить ее согласно примеру.
| Формула кислоты | Название | Тип кислоты | Основность | Тип элек-тролита | Соответству-ющий оксид | |
| HCl | соляная | бескислородная | одноосновная | сильный | - | |

| угольная | кислородосодержащая | двухосновная | слабый | 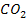
| |
| …… | ……. | ………………… | …………….. | …………. | ……..... | |
Упражнения
С какими из приведенных веществ будет реагировать данная кислота? Написать уравнения реакций
33. 
34. 
35. 
36. 
37. 
38. 
39. 
40. 
41. 
42. 
43. 
44. 
45. 
46. 
47. 
48. 
Задачи
49. При взаимодействии соляной кислоты с карбонатом натрия выделилось 5,6 л углекислого газа (нормальные условия). Сколько граммов соли при этом образовалось?
50. Сколько граммов серного ангидрида потребуется для получения 4,9 г серной кислоты?
51. Сколько литров сероводорода (нормальные условия) выделится при действии серной кислоты на 43,5 г сульфида цинка?
52. При взаимодействии цинка с соляной кислотой выделилось 5,6 л газа (нормальные условия). Сколько граммов соли при этом образовалось?
53. Сколько литров газообразного хлора (нормальные условия) необходимо для получения раствора соляной кислоты, содержащего 146 г  ?
?
54. Какое количество нитрата меди (II) образуется при взаимодействии 20 г оксида меди (II) с азотной кислотой? Какое количество азотной кислоты будет израсходовано?
55. Какую массу магния надо растворить в соляной кислоте, чтобы образовалось 47,5 г хлорида магния? Сколько литров водорода (нормальные условия) при этом выделится?
56. Определить массу сульфата железа (II), полученного при растворении в серной кислоте 11,2 г железа, и объем полученного выделившегося водорода (нормальные условия)?
57. Сколько граммов соляной кислоты потребуется для превращения 40 г оксида меди(II) в хлорид меди (II)? Какая масса соли при этом образуется?
58. Сколько граммов воды выделится при нейтрализации 10 г гидроксида натрия серной кислотой? Сколько молей соли при этом образуется?
59. Сколько литров оксида углерода(IV) (нормальные условия) выделится при действии соляной кислоты на 25 г карбоната кальция?
60. Сколько граммов цинка необходимо взять, чтобы при растворении его в соляной кислоте выделилось 5,6 л водорода (нормальные условия)? Сколько граммов соли при этом образуется?
61. Сколько литров водорода (нормальные условия) выделится при растворении 9 г алюминия в серной кислоте? Сколько граммов соли при этом образуется?
62. Сколько граммов нитрата меди(II) образуется при взаимодействии 24,5 г гидроксида меди(II) с азотной кислотой? Сколько граммов азотной кислоты будет израсходовано?
63. Сколько граммов нитрата кальция получится при нейтрализации раствора, содержащего 31,5 г азотной кислоты, гидроксидом кальция?
64. При растворении алюминия в соляной кислоте выделилось 5,6 л водорода (нормальные условия). Сколько граммов хлорида алюминия при этом образовалось?
Соли
В данной работе рассматривается три типа солей – средние, кислые и основные.
Главной реакцией получения солей является реакция нейтрализации – взаимодействие кислоты с основанием. Любую соль можно рассматривать как продукт замещения ионов водорода в кислоте на катионы основания, или как продукт замещения гидроксо-ионов основания на анионы – кислотные остатки кислоты. При этом происходит соединение ионов водорода кислоты с гидроксо-ионами основания, т.е. эти ионы нейтрализуют друг друга – отсюда название “реакция нейтрализации”.
Если происходит полное замещение ионов по указанным схемам и при этом все ионы водорода кислоты соединяются со всеми гидроксо-ионами основания, то образуется средняя соль. Если водород в кислоте замещен не полностью, то образуется кислая соль, а если гидроксо-ионы в основании замещены не полностью, то образуется основная соль.
Рассмотрим в качестве примера реакцию между серной кислотой и гидроксидом кальция. Реакция может происходить по трем направлениям:
1. 
В этой реакции кислота взята в избытке, а основание – в недостатке. Получилась кислая соль.
2. 
В этой реакции наоборот, основание взято в избытке, а кислота – в недостатке. Получена основная соль.
3. 
В этой реакции кислоты и основания взято столько, чтобы все ионы водорода кислоты соединились со всеми гидроксо-ионами основания, и в результате образовалась средняя соль.
Таким образом, при реакции нейтрализации в зависимости от условий проведения процесса могут быть получены все три типа солей.
Представляется очевидным, что одноосновные кислоты не могут образовывать кислые соли, а однокислотные основания – основные соли.
Для того, чтобы из средней соли получить кислую, надо добавить к ней соответствующую кислоту
 ,
,
А чтобы получить основную – добавить основание

И наоборот, чтобы перевести кислую соль в среднюю, надо добавить основание, а чтобы перевести основную в среднюю – добавить кислоту


С точки зрения электролитической диссоциации все соли являются сильными электролитами.
Методы получения солей
1. Реакция нейтрализации

2. Взаимодействие метала с неметаллом
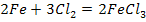
3. Взаимодействие метала с кислотой

4. Взаимодействие основного оксида с кислотным

5. Взаимодействие основного оксида с кислотой

6. Взаимодействие кислотного оксида с основанием

7. Взаимодействие аммиака с кислотами с образованием солей аммония


Химические свойства солей
1. Многие соли способны разлагаться при нагревании. Разложение солей различного состава происходит по-разному и является предметом рассмотрения в курсе неорганической химии.
Некоторые соли (карбонаты, сульфаты) разлагаются при нагревании на кислотный и основной оксиды


Соли щелочных металлов обычно устойчивы при нагревании.
Перечисленные ниже химические свойства солей являются одновременно методами получения одной соли из другой.
2. Взаимодействие металла с солью

Эти реакции протекают в том случае, если реагирующий металл стоит в ряду напряжений левее металла, входящего в состав соли. Иными словами, более активный металл вытеснят менее активный из соли.
Щелочные и щелочно-земельные металлы не вытесняют друг друга из солей.
Большинство реакций, отражающих химические свойства солей, приведенные в пунктах 1-5, происходят в растворах и протекают необратимо (или как принято говорить – “до конца”), если в результате процесса образуется: а) осадок, б) газ, в) слабый электролит. Если эти правила не выполняются, реакция до конца не идет. Например, реакция
 ,
,
существует только на бумаге.
При написании реакций в растворах следует указывать, почему эта реакция идет до конца.
3. Взаимодействие соли со щелочью


4. Взаимодействие соли с кислотой
 (сл. эл-т)
(сл. эл-т)
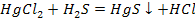
Последняя реакция, на первый взгляд, противоречит правилу, указанному в химических свойствах кислот, а именно, что сильные кислоты вытесняют слабые из их солей. В приведенном примере, наоборот, слабая кислота вытесняет сильную ( ). Однако вторым продуктом реакции является нерастворимая соль,
). Однако вторым продуктом реакции является нерастворимая соль,  , выпадающая в осадок. Поэтому данная реакция идет до конца.
, выпадающая в осадок. Поэтому данная реакция идет до конца.
5. Взаимодействие в растворе двух солей между собой


Контрольные задания IV
Упражнения
Получите всеми возможными способами следующие соли (№№1-24)
1. Карбонат натрия
- Сульфат бария
- Нитрат калия
- Хлорид цинка
- Хлорид серебра
- Карбонат кальция
- Фосфат натрия
- Сульфат аммония
- Нитрат бария
- Сульфат железа(III)
- Сульфат ртути(II)
- Силикат калия
- Нитрит магния
- Сульфит натрия
- Нитрат меди(II)
- Хлорид аммония
- Фосфат кальция
- Бромид серебра
- Нитрат железа(III)
- Сульфид натрия
- Силикат натрия
- Сульфид меди(II)
- Хлорид натрия
- Сульфат железа(III).
Назвать все вещества в цепочках и осуществить указанные превращения (№№25-40)
25.