Равновесия в системах «насыщенный раствор - осадок»
Механизм образования осадков
На первый взгляд образование осадков идет по одинаковому механизму:
Ag++Cl-→AgCl↓
Ba2++SO42-→BaSO4↓
На самом деле осадки AgCl↓ и BaSO4↓ состоят из отдельных кристаллов, включающих в себя огромное число ионов, расположенных строго определенным образом.
Рассмотрим механизм образования осадков. Образование осадков происходит в пересыщенных растворах в несколько стадий:
1) Индукционный период – время до появления первых признаков осадка. Величина этого периода зависит от химической природы образующегося осадка (при осаждении BaSO4 индукционный период сравнительно велик, при осаждении AgCl – очень непродолжительный), концентрации реагентов, чистоты реагентов и т.д. Процесс образования осадка начинается с возникновения первичных центров кристаллизации (первичных зародышей), которое может быть спонтанным (гомогенным) или индуцированным (гетерогенным) В первом случае в растворе образуется группа ионов, размер которой превышает некоторую критическую величину. Во втором случае образование первичного зародыша происходит в результате адсорбции ионов на поверхности посторонней частицы (пылинки). Гетерогенный механизм образования центров кристаллизации встречается чаще, чем гомогенный.
Процесс образования первичного зародыша можно представить следующим образом:
Ag++Cl-→AgCl
AgCl +Ag+→(Ag2Cl)+
(Ag2Cl)++Cl-→(AgCl)2
До тех пор, пока не образуется (AgCl)n. Размер критического зародыша, т.е. величина n, зависит от природы ионов и составляет от 2 до 9. Частицы, содержащие меньше ионов, чем критический зародыш, склонны к разрушению и растворению.
2) Рост кристаллов. Укрупнение частиц осадка включает в себя такие процессы, как диффузия ионов к поверхности осадка, адсорбция их на поверхности и включение в кристаллическую решетку. Образующиеся осадки могут быть кристаллическими или аморфными. Большинство аморфных осадков также имеют кристаллическую структуру, но состоят из множества слабо связанных между собой очень маленьких кристаллов.
Характер образующегося осадка определяется соотношением скоростей двух процессов: образования зародышей и роста первичных центров кристаллизации, а это соотношение зависит от относительного пересыщения (ОП) раствора, возникающего при добавлении раствора осадителя:
ОП = (Q - S) /S,
где Q - концентрация осаждаемого вещества в какой-либо момент времени; S – концентрация осаждаемого вещества в насыщенном растворе (растворимость).
Скорости процессов образования первичных зародышей и роста кристаллов связаны с ОП уравнением:
u=k×(ОП)n
Для образования зародышей n=4, для роста кристаллов n=1. Однако k для процесса кристаллизации больше.

При малых значениях ОП преобладает рост кристаллов, вследствие чего образуется малое количество крупных кристаллов, при больших – образование новых первичных центров кристаллизации, поэтому образуется множество мелких кристаллов.
3) Послеосаждение. Это образование второго малорастворимого соединения на поверхности уже образовавшегося первого осадка. При осаждении ионов кальция из раствора, содержащего ионы кальция и магния действием раствора оксалата, первым выпадает осадок CaC2O4, а Mg2+ остается в растворе в пересыщенном состоянии. Через некоторое время на поверхности CaC2O4 осаждается MgC2O4.
4) Старение осадка. Совершенствование его структуры:
Ø Рекристаллизация первичных частиц – перенос вещества от мелких частиц к более крупным после растворения мелких;
Ø Термическое старение – совершенствование структуры за счет теплового движения;
Ø Соединение мелких частиц в более крупные (агломераты);
Ø Переход от аморфного осадка к кристаллическому при повышении температуры смеси.
Соосаждение
Соосаждением называют явление образования осадка веществом, которое должно было бы оставаться в растворе, так как в условиях осаждения оно хорошо растворимо.
ПР: к смеси растворов BaCl2 и KMnO4 добавляют H2SO4 до сильнокислой реакции, образуется белый осадок BaSO4, а раствор остается окрашенным в фиолетовый цвет. К раствору прибавляют восстановитель (Na2SO3), в результате чего раствор над осадком обесцвечивается (MnO4- восстанавливается до Mn2+). При этом осадок оказывается окрашенным в фиолетовый цвет, т.е. происходит соосаждение MnO4- с BaSO4.
Различают несколько видов соосаждения: адсорбция, окклюзия, изоморфное соосаждение и инклюзия.
Адсорбция. Осаждение примесей на поверхности образующегося осадка. Адсорбция примесей приводит к увеличению массы осадка по сравнению с ожидаемой и, следовательно, к получению завышенных результатов анализа. Процесс адсорбции ионов на осадке подчиняется правилу Фаянса-Панета-Хана. Согласно этому правилу, на осадке адсорбируются ионы, образующие с противоположно заряженными ионами осадка малорастворимое соединение (на осадке AgCl будут адсорбироваться ионы Ag+ и Cl-, на осадке BaSO4 – ионы Ba2+ и SO42-). Адсорбирующиеся ионы могут отличаться от ионов осадка: на осадке AgCl могут адсорбироваться ионы Br- и I-, образующие с серобром малорастворимые соединения.
Степень адсорбции иона на осадке зависит от его концентрации в растворе (изотерма адсорбции Лэнгмюра) и заряда. Адсорбция является экзотермическим процессом, следовательно, при повышении температуры она уменьшается.
Окклюзия. Явление попадания первоначально адсорбированной на поверхности примеси внутрь осадка. Окклюзия может приводить как к увеличению массы осадка, так и к ее уменьшению. Окклюзия подчиняется тем же законам, что и адсорбция. Вид окклюдируемых ионов зависит от порядка добавления реагентов. Для уменьшения окклюзии осаждение необходимо проводить медленно. Окклюдированные примеси удаляются в процессе «старения» осадка и при его переосаждении.
Изоморфное соосаждение. Это явление характерно для соединений, способных образовывать совместную кристаллическую решетку (вместе сBaSO4 могут совместно соосаждаться PbSO4 – похожие катионы и одинаковые анионы). Устранение – предварительное удаление из раствора мешающих ионов.
Инклюзия. Самый редкий вид соосаждения. Это процесс захвата растущим осадком некоторого количества маточного раствора. За счет инклюзии в осадок попадают молекулы растворителя: их можно легко удалить прокалив осадок.
Произведение растворимости. Растворимость
Рассмотрим обратимую систему, состоящую из малорастворимого электролита и насыщенного раствора над ним, содержащего ионы этого электролита:
MmAn «mMn+ + nAm-
К такой системе применим закон действующих масс:
При установившемся равновесии скоростей образования и растворения осадка в насыщенном растворе малорастворимого электролита при данных температуре и давлении произведение концентрации его ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная – произведение растворимости (ПР).
Для малорастворимого электролита состава МmАn выражение ПР запишется следующим образом:

где  - равновесные концентрации ионов в растворе, моль/л;
- равновесные концентрации ионов в растворе, моль/л;
n, m – стехиометрические коэффициенты.
В некоторых случаях говорят не о ПР, а о произведении активностей (ПА).
Понятие активности и коэффициента активности было введено для растворов сильных электролитов, имеющих концентрацию не меньше 10-3 моль/л, а также для растворов слабых электролитов высокой концентрации. Это связано с тем, что в концентрированных растворах ионы не могут «проявлять» себя в полной мере, так как движение одних ионов затрудняется действием других. Поэтому реальная (действующая) их концентрация оказывается ниже теоретического значения. Поэтому вводится понятие активности:

где  – активность иона, моль/л;
– активность иона, моль/л;
 – теоретическая концентрация иона, моль/л;
– теоретическая концентрация иона, моль/л;
 - коэффициент активности.
- коэффициент активности.
Коэффициент активности – это коэффициент пропорциональности между активностью и концентрацией иона. Величина коэффициента активности зависит от типа (заряда) иона и ионной силы раствора. В разбавленных растворах (концентрация меньше 10-3 моль/л)  , т.е.
, т.е. 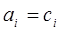 .
.
 |
Ионная сила раствора – это полусумма произведений концентраций ионов в растворе на квадрат их зарядов, т.е.
где  – концентрация иона в растворе, моль/л;
– концентрация иона в растворе, моль/л;
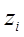 – заряд иона.
– заряд иона.
Для электролита состава МmАn произведение активностей
