ОСНОВНЫЕ ТИПЫХИМИЧЕСКИХ РЕАКЦИЙ, ИСПОЛЬЗУЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
Равновесие в системе осадок – раствор
Гетерогенная (неоднородная) система состоит из двух фаз: насыщенного раствора электролита и осадка. В этой системе устанавливается динамическое равновесие:
BaSO4↓↔Ва2+ + SO42-
К этой равновесной системе применим закон действия масс, исходя из которого можно сформулировать правило произведения растворимости (ПР): произведение концентраций ионов труднорастворимого электролита в его насыщенном растворе есть величина постоянная при данной температуре:
ПР BaSO4 = [Ва2+] [SO4 2-]
Если в формуле имеются стехиометрические коэффициенты, то они входят в уравнение как показатели степени, в которые необходимо возвести концентрации ионов, например,:
ПРCa3 (PO4)2 = [Са2+] 3 [PO43-] 2
Произведение растворимости характеризует растворимость вещества: чем больше значение ПР, тем больше растворимость. При более точных расчетах необходимо вместо концентраций ионов использовать значения активностей, учитывающих электростатические взаимодействия между ионами. Активности ионов пропорциональны концентрациям:
а = ν С. (1.1)
Здесь ν = а / С – коэффициент активности, зависящий от концентраций и зарядов всех ионов в растворе, а также от собственного заряда иона. Для нахождения коэффициентов активности сначала рассчитывают ионную силу раствора I по формуле:
 (1.2)
(1.2)
где Сi и zi – молярные концентрации и заряды всех ионов в растворе.
Пример 1. Вычислить произведение растворимости иодида серебра AgI, если растворимость этой соли при температуре 25°С равна 2,865 ∙ 10–6 г/л
Решение. Химическое равновесие в насыщенном растворе AgI описывается уравнением
AgI↓↔ Ag+ + I–
Запишем выражение произведения растворимости для иодида серебра:
ПРAgI = [Ag+] [I–]
Вычислим растворимость иодида серебра (моль/л). Так как молярная масса AgI составляет 234,772 г/моль, то концентрация AgI в растворе будет:
[AgI] = 2,865 ∙ 10–6/ 234,772 = 1,22 ∙ 10–8 моль/л.
При диссоциации каждого моля иодида серебра образуется 1 моль Ag+ и 1 моль I–.
Следовательно, их концентрации равны:
[Ag+] = [I–] = [AgI] = 1,22 ∙ 10–8 моль/л.
Подставляя значения [Ag+] и [I–] в уравнение произведения растворимости, получим:
ПРAgI = 1,22 ∙ 10–8 ∙ 1,22 ∙ 10–8 = 1,5 ∙ 10–16.
Пример 2. Вычислить произведение растворимости Ag2CrO4, если в 100 мл насыщенного раствора его содержится 0,002156 г.
Решение. Найдем растворимость хромата серебра (моль/л):
в 100 мл насыщенного раствора – 0,002156 г соли
в 1000 мл х г соли
x = 1000 ∙ 0,002156 / 100 = 0,02156 г/л.
Молярная масса Ag2CrO4 равна 331,73 г/моль, тогда растворимость Ag2CrO4 (моль/л) будет:
[Ag2CrO4] = 0,02156 / 331,73 моль/л = 6,5 ∙ 10–5 моль/л.
Хромат серебра диссоциирует следующим образом:
Ag2CrO4↓↔2Ag+ + CrO42-
Тогда
[Ag+] = 2 ∙ 6,5 ∙ 10–5 = 1,3 ∙ 10–4 моль/л;
[CrO42-] = 6,5 ∙ 10–5 моль/л;
ПР Ag2CrO4 = [Ag+]2[CrO42-] = (1,3 ∙ 10–4)2 ∙ 6,5 ∙ 10–5 ≈ 1,1 ∙ 10–11.
Задачи для самостоятельного решения:
Вычислить произведение растворимости соли:
1. CaF2, если массовая концентрация насыщенного раствора соли составляет 0,017 г/л.
2. MgNH4PO4, если при анализе 1000 мл насыщенного раствора найдено 7,9 мг этой соли.
Кислотно-основное равновесие
Кислотно-основное (протолитическое) взаимодействие состоит в обратимом переносе протона от молекулы кислоты к молекуле основания. При этом кислота превращается в сопряженное с ней основание, а основание становится сопряженной кислотой. На практике наиболее часто имеют дело именно с протолитическими равновесиями (реакции нейтрализации, гидролиза и диссоциации).
Наибольшее признание из всех известных теорий кислот и оснований получила протолитическая теория Бренстеда и Лоури. Согласно этой теории, кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Иначе говоря, кислота является донором, а основание – акцептором протонов. Существуют также вещества, способные как отдавать, так и принимать протоны. Они называются амфолитами. В водных растворах сильных одноосновных

 кислот протолитическое равновесие HA + H2O H3O+ + A– целиком сдвинуто вправо, и концентрация ионов водорода совпадает с концентрацией кислоты. Слабые кислоты и основания в водных растворах диссоциированы лишь частично. На основании анализа равновесий в растворах выводятся основные уравнения для расчета рН.
кислот протолитическое равновесие HA + H2O H3O+ + A– целиком сдвинуто вправо, и концентрация ионов водорода совпадает с концентрацией кислоты. Слабые кислоты и основания в водных растворах диссоциированы лишь частично. На основании анализа равновесий в растворах выводятся основные уравнения для расчета рН.
Расчет рН растворов электролитов проводится по следующим (упрощенным) формулам:
pH = – lg C кислоты (1.1)
слабых кислот
 (1.2)
(1.2)
сильных однокислотных оснований
pH = 14 + lg C основания (1.3)
слабых оснований
 (1.4.)
(1.4.)
 солей слабых кислот
солей слабых кислот
(1.5)
солей слабых оснований
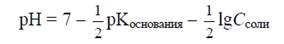 (1.6)
(1.6)
буферных растворов, образованных слабой кислотой и ее солью (солью слабой кислоты и сильного или слабого основания):
 (1.7)
(1.7)
буферных растворов, образованных слабым основанием и ее солью (солью слабого основания и сильной или слабой кислоты):
 (1.8)
(1.8)
амфолитов (кислых солей)
pH = (pKn + pKn+1) / 2 (1.9)
Пример: Вычислить рН раствора, полученного при сливании:
а) 20,0 мл 0,1 М раствора NaOH и 16,0 мл 0,08 М раствора HCl.
б) 20,0 мл 0,1 М раствора NaOH и 36,0 мл 0,08 М раствора HCl.
Решение а. Запишем уравнение реакции:
NaOH + HCl = NaCl + H2O
С целью выяснения состава раствора, образовавшегося после сливания, рассчитаем количества веществ в исходных растворах:
n 0(NaOH) = 20,0 ∙ 10–3 ∙ 0,1 = 2,0 ∙ 10–3 моль;
n 0(HCl) = 16,0 ∙ 10–3 ∙ 0,08 = 1,28 ∙ 10–3 моль.
Так как n 0(NaOH) > n 0(HCl), то NaOH находится в избытке, следовательно, в образовавшемся после сливания растворе будут находиться NaOH и NaCl в следующих количествах:
n 1(NaOH) = n 0(NaOH) – n 0(HCl) = 2,0 ∙ 10–3 – 1,28 ∙ 10–3 = 0,72 ∙ 10–3 моль.
NaCl является солью сильной кислоты и сильного основания и на pH не влияет.
Объем раствора (V) составит 20,0 + 16,0 = 36,0 мл.
Рассчитаем концентрацию NaOH в растворе:
С (NaOH) = 0,72 ∙ 10–3/ 36 ∙ 10–3 = 0,02 моль/л.
Исходя из состава раствора, выбираем формулу (1.3) для расчета рН сильного основания:
pH = 14 + lg C (NaOH) = 14 + lg(0,02) = 12,3
Решение б:
Запишем уравнение реакции:
NaOH + HCl = NaCl + H2O
С целью выяснения состава раствора, образовавшегося после сливания, рассчитаем количества веществ в исходных растворах:
n 0(NaOH) = 20,0 ∙ 10–3 ∙ 0,1 = 2,0 ∙ 10–3 моль;
n 0(HCl) = 36,0 ∙ 10–3 ∙ 0,08 = 2,88 ∙ 10–3 моль.
Так как n 0(NaOH) < n 0(HCl), то HCl находится в избытке, следовательно, в образовавшемся после сливания растворе присутствовать HCl и NaCl в следующих количествах:
n 1(HCl) = n 0(HCl) – n 0(NaOH) = 2,88 ∙ 10–3 – 2,0 ∙ 10–3 = 0,88 ∙ 10–3 моль/
NaCl является солью сильной кислоты и сильного основания и на pH не влияет.
Объем раствора (V) составит 20,0 + 36,0 = 56,0 мл.
Рассчитаем концентрацию HCl в растворе:
С (HCl) = 0,88 ∙ 10–3/ 56 ∙ 10–3 = 0,0157 моль/л.
Исходя из состава раствора, выбираем формулу (1.1) для расчета рН сильного основания:
pH = lgC(HCl) = lg(0,0157) = 1,8.
Задачи для самостоятельного решения:
Вычислить рН раствора, полученного при сливании растворов
А) 20,0 мл 0,12 М NaOH 5,2 мл 0,24 М HCl
Б) 20,0 мл 0,25 М NaOH 10,2 мл 0,5 М раствора HCl