КУРС ПРАКТИЧЕСКИХ РАБОТ
Учебной дисциплины «ХИМИЯ»
по профессии:
Слесарь по ремонту строительных машин
Квалификации – слесарь по ремонту автомобилей, электрогазосварщик
Мастер общестроительных работ
Квалификации – каменщик, электросварщик ручной сварки
Мастер отделочных строительных работ
Квалификации – маляр, штукатур, облицовщик-плиточник
Мастер столярно-плотничных и паркетных работ
Квалификации – столяр строительный, плотник, паркетчик
Разработан:
Ю.Н.Тубальцевой
Симферополь, 2017
ПРАКТИЧЕСКАЯ РАБОТА № 1
Тема: Расчетные задачи на нахождение относительной молекулярной массы. Определение массовой доли.
Норма времени: 2 часа.
Цели и задачи: закрепить умения и навыки решения задач на нахождение относительной молекулярной массы, закрепить умения и навыки решения задач на определение массовой доли химических элементов в сложном веществе.
Приобретаемые умения и навыки: развитие умений и навыков работы с теоретическим материалом, анализировать, делать выводы, решения задач, – формирование аналитической и практической компетенции, решение расчетных задач по химическим формулам и уравнениям.
Оснащение рабочего места: рабочая тетрадь, задания, калькулятор.
Литература: Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
Краткие теоретические сведения
1.Нахождение относительной молекулярной массы вещества H2 SО4:
Аr(H) = 1;
Ar(S) = 32;
Ar(0)=16.
Мr = Ar (H)•2+ Ar(S)•1+Ar(o)•4 = 1•2 + 32 + 16•4= 98 г/моль
Ответ: = 98.
2. Нахождение молекулярной массы (Мr) нитробензола С6 Н5 NO2.
Решение:
Мr= 6Аr(С) + 5Аr(Н) + Аr(N) + 2Аr(О) = 6 × 12 + 5×1 + 14 + 2×16 = 123
для нахождения массы молекулы нитробензола в а.е.м. надо найденное значение умножить на 1 а.е.м.. Получаем 123 а.е.м.
Ответ: 123; 123 а.е.м.
Дано:
Вещество: 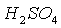 Найти:
w(H) –?
Найти:
w(H) –?
|
Решение:
w(H)=  0,020 или 2,0 %
Ответ:w(H) = 2,0%. 0,020 или 2,0 %
Ответ:w(H) = 2,0%.
|
Содержание работы
Вариант 1
Задание 1:
Рассчитайте молекулярные массы веществ: NaCL, MgSO4, KOH.
Задание 2:
Выберите правильный ответ.
1-Масса вещества, формула которого CaCO3, равна:
a) 68;
b) 100;
c) 90;
d) 88
2-Масса вещества, формула которого Mg(NO3)2, равна:
a) 54
b) 148
c) 86
d) 564
3-Масса вещества, формула которого CuSO4, равна:
a) 160
b) 112
c) 128
d) 88
4-Масса вещества, формула которого Na2CO3, равна:
a) 51
b) 74
c) 106
d) 92
5-Масса вещества, формула которого AlCl3, равна:
a) 62
b) 48
c) 133,5
d) 205
Задание 3:
Выберите правильный ответ: Массовые отношения химических элементов в формулах веществ равны:
А)CuSO4;
1. 64:32:64
- 2:1:2
- 16:8:16
- 4:2:41.
Б)CaCO3
- 10:3:12
- 40:12:48
- 40:12:16
- 10:3:4
Задание 4
Рассчитайте массовые доли химических элементов в веществе HNO3.
Задание 5:
Рассчитайте массовые доли химических элементов в веществе Ca(OH)2
Вариант 2
Задание 1
Рассчитайте молекулярные массы веществ: KCL, CaSO4, NaOH.
Задание 2:
Выберите правильный ответ.
1-Масса вещества, формула которого Ca(НCO3)2, равна:
a) 68;
b) 100;
c) 90;
d) 162
2-Масса вещества, формула которого MgCL2, равна:
a) 54
b) 148
c) 86
d) 95
3-Масса вещества, формула которого CuSO4, равна:
a) 160
b) 112
c) 128
d) 88
4-Масса вещества, формула которого K2CO3, равна:
a) 51
b) 74
c) 138
d) 92
5-Масса вещества, формула которого AlCl3, равна:
a) 62
b) 48
c) 133,5
d) 205
Задание 3:
Выберите правильный ответ: Массовые отношения химических элементов в формулах веществ равны:
А)CuSO4;
1. 64:32:64
2. 2:1:2
3. 16:8:16
4. 4:2:41
Б)CaCO3
1. 10:3:12
2. 40:12:48
3. 40:12:16
4. 10:3:4
Задание 4
Рассчитайте массовые доли химических элементов в веществе H3PO4.
Задание 5:
Рассчитайте массовые доли химических элементов в веществе Zn(OH)2
Контрольные вопросы
1. Дайте определение молекулярной массы.
2. Дайте определение атомной массы.
3. Как рассчитывается молекулярная масса?
4. Назовите единицы измерения молекулярной массы.
5. Дайте определение массовой доли.
6. По какой формуле рассчитывается массовая доля элементов в молекуле?
7. Рассчитайте массовые доли химических элементов в веществе: Na2CO3, Ca(NO3)2, Ag NO3, KCl, H2SO4, Ba(NO3)2, Na2S
Преподаватель: Тубальцева Ю.Н.
ПРАКТИЧЕСКАЯ РАБОТА № 2
Тема: Приготовление раствора заданной концентрации.
Норма времени: 2 часа.
Цели и задачи: закрепить умения и навыки расчета массы исходных веществ для приготовления раствора заданной концентрации, умения и навыки приготовления раствора заданной концентрации.
Приобретаемые умения и навыки: продолжить работу по формированию исследовательской, аналитической и практической компетентностей; развитию логического мышления.
Оснащение рабочего места:
- реактивы: соль хлорид натрия, вода.
- оборудование: таблица растворимости, таблица Д.И.Менделеева, инструкция, мерный стакан, химический стакан, весы.
Литература: Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
Краткие теоретические сведения
W=(m вещества/mраствора) *100%
m вещества = (W/100%) * mраствора
mрастворителя = mраствора - m вещества
Содержание работы
Вариант 1
1. Рассчитайте массу хлорида натрия и воды, необходимые для приготовления:
a) 100 мл 1 % раствора хлорида натрия
b) 50 мл 20% раствора хлорида натрия.
2. Взвесьте, рассчитанную ранее массу соли и отмерьте рассчитанное количество воды.
3. Насыпьте в мерочный стакан хлорид натрия и добавьте до нужной метки воды.
4. Проверьте, правильно ли вы добавили воду до отметки. Мениск должен нижним краем касаться черты.
5. Сделайте выводы о проделанной работе.
Вариант 2
1) Рассчитайте массу хлорида натрия и воды, необходимые для приготовления:
a) 50 мл 1 % раствора хлорида натрия
b) 100 мл 20% раствора хлорида натрия.
2) Взвесьте, рассчитанную ранее массу соли и отмерьте рассчитанное количество воды.
3) Насыпьте в мерочный стакан хлорид натрия и добавьте до нужной метки воды.
4) Проверьте, правильно ли вы добавили воду до отметки. Мениск должен нижним краем касаться черты.
5) Сделайте выводы о проделанной работе.
Контрольные вопросы
1) Что такое массовая доля раствора?
2) Что такое молярная концентрация раствора?
3) Какие концентрации вы рассчитывали на прошлом уроке?
4) По каким формулам вы рассчитывали массовую долю и солярную концентрацию?
5) Физраствор, который используют в медицине, содержит 0.9% хлорида натрия. Как приготовить такой раствор в домашних условиях?
Преподаватель: Тубальцева Ю.Н.
ПРАКТИЧЕСКАЯ РАБОТА № 3
Тема: Получение, собирание и распознавание газов.
Норма времени: 2 часа.
Цели и задачи: научиться, опытным путем получать, собирать и распознавать газы в лабораторных условиях.
Приобретаемые умения и навыки: продолжить формирование умений работы в химической лаборатории, проведения расчетов по химическим формулам и уравнениям.
Оснащение рабочего места:
- реактивы: соляная кислота, мел, хлорид аммония, гидроксид натрия, известковый раствор.
- оборудование: штатив с пробирками, прибор для получения газов, химический стакан, индикаторная бумага.
Литература: Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.