- Степень окисления (C.О.) кислорода в большинстве соединений равна -2 за исключением пероксидов (Н2О2) и дифторида кислорода (OF2). С.О. в них равна -1 и +2, соотвтственно.
- С.О. водорода равна +1 за исключением гидридов металлов (NaH, CaH2 и др. С.О.= -1).
- Алгебраическая сумма степеней окисления в молекуле всегда равна 0, а в сложном ионе - заряду иона.
4. Степень окисления элемента в простых веществах принимается за 0.
Алгоритм вычисления степени окисления в бинарной (состоящей из двух химических элементов) молекуле.
Пример: MnO2
| Записываем формулу вещества | MnO2 | |
| Ставим известную степень окисления над химическим элементом, а неизвестную степень окисления обозначаем через Х | х -2 MnO2 | |
| Алгебраическая сумма степеней окисления в молекуле равна 0 (т.е., молекула заряда не имеет) | х -2 (MnO2) 0 | |
| Cоставляем уравнение | х + (-2)∙ 2 = 0 | |
| Решаем уравнение | х - 4 = 0; х = +4 |
Вывод: степень окисления марганца в MnO2 равна + 4.
- В оксидах с нечетным числом атомов кислорода степень окисления элемента (если произвести расчет) равна этому нечетному числу («перекрестное» правило)
со знаком +: х -2
Э2О3
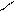
 х -2
х -2
Э2О3 2∙х = - [3 ∙ (-2)]
- [3 ∙ (-2)]
х = ----------- = +3
Алгоритм вычисления степени окисления в сложной молекуле.
Пример: H2Cr2O7
| Записываем формулу вещества | H2Cr2O7 | |
| Ставим известные степени окисления над химическими элементами, а неизвестную степень окисления обозначаем через Х | +1 х -2 H2Cr2O7 | |
| Алгебраическая сумма степеней окисления в молекуле равна 0 (т.е., молекула заряда не имеет) | +1 х -2 (H2Cr2O7)0 | |
| Cоставляем уравнение | (+1) ∙ 2 + х ∙ 2 + (-2)∙ 7 = 0 | |
| Решаем уравнение | 2+2х -14 = 0 2х = 14-2; 2х = 12; х = +6 |
Вывод: степень окисления хрома в хромовой кислоте равна +6.
7.
Алгоритм вычисления степени окисления в сложном ионе.
Пример: РO43-
| Записываем формулу иона | РO43- | |
| Ставим известные степени окисления над химическими элементами, а неизвестную степень окисления обозначаем через х | х -2 РO43- | |
| Алгебраическая сумма степеней окисления в ионе равна заряду иона | -3 | |
| Cоставляем уравнение | х + (-2) ∙ 4 = -3 | |
| Решаем уравнение | х = +8-3 = +5 |
Вывод: степень окисления фосфора в ортофосфат - ионе равна +5.
• Если вы вычислили степень элемента в составе сложного аниона или сложного катиона один раз, а этот ион встречается в уравнении повторно, например H3PO4 и Ca3(PO4)2, то степень окисления у фосфора будет та же самая +5.
Задание для самоконтроля № 2.
Вычислите степени окисления азота в соединениях: NaNO3, NO2, HNO2, NH4OH, NH4NO2, HNO3, N2H4, NH2OH, N2, NH3.
Задание для самоконтроля № 3.
Вычислите степени окисления элементов в ионах: СO32-, PH4+, SO42-,
S2O32-, SiO44-.
Вычисления степеней окисления атома углерода в органических соединениях.
Пример № 1
Вычислить степень окисления атомов углерода в пропане.
- Делим молекулу на части, отделяя каждый атом углерода с присоединенными к нему атомами водорода:

 СН3 - СН2 - СН3 СН3 - СН2 - СН3
СН3 - СН2 - СН3 СН3 - СН2 - СН3
пропан а) б) в)
- Общий заряд каждой части принимают за 0.
- По суммарной степени окисления всех атомов, которые окружают атом углерода, приняв степень окисления углерода за Х, рассчитываем искомую степень окисления, то есть, Х:
для а) и в) х +1
(СН3) 0 à х ∙ 1 + (+1) ∙3 = 0; х = -3
для б) х +1
(СН2) 0 à х ∙ 1 + (+1) ∙ 2 = 0; х = -2
Иногда рассчитывают среднюю степень окисления атома углерода через эмпирическую (молекулярную) формулу:
Х +1
С3Н8 3х + 8 = 0 à 3х = -8 à х = 8: 3 = + 2,66
пропан
Таким образом, получено дробное значение степени окисления, пользоваться им неудобно.
Пример № 2
Вычислить степень окисления атомов углерода в уксусной кислоте:
СН3СООН
-2
О
х +1 у// -2 +1
 CH3 - C - O - H
CH3 - C - O - H
а) б)
По первому способу:
для а)
х +1
(СН3) 0 à х ∙ 1 + (+1) ∙3 = 0; х = -3
для б)
у -2 -2 +1
(С О О Н)0 à у + (-2) ∙ 2 + 1 ∙ (+1) = 0
у = 4 -1 = +3
х +1 -2
По второму способу: С2Н4О2 à х ∙ 2 + 4 ∙ (+1) + 2 ∙ (-2) = 0
2х + 4 - 4 = 0; 2х = 0; х = 0