Представим исходные термодинамические данные в таблице 3.
Таблица 3
| Химический элемент | Коэффициенты уравнения 
|  кДж/моль
кДж/моль
| 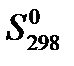 , ,

| ||
| a | 
| 
| |||
| MgCO3 | 77,91 | 57,74 | -17,41 | -1095,85 | 65,10 |
| MgO | 48,98 | 3,14 | -11,34 | -601,49 | 27,07 |
| CO2 | 44,14 | 9,04 | -8,54 | -393,51 | 213,66 |
Диссоциация карбоната магния происходит по реакции:

Для определения изобарно-изотермического потенциала нам понадобится рассчитать энтальпию и энтропию реакции:
Энтальпия рассчитвается по формуле:


Энтропия равна:


Изобарно-изотермический потенциал (энергия Гиббса), при температуре 298 К равен:


Найдем изобарно-изотермический потенциал при температурах 350 0С, 500 0С,
650 0С и 800 0С.
Рассчитаем коэффициенты уравнения 



Итого



Рассчитаем энтальпию реакции при температуре 350 0C(623 К) исходя из формулы изобарной теплоемкости вещества и уравнения Кирхгофа:






Абсолютная энтропия реакции при определенной температуре равна:




Аналогично производятся расчеты для температур 500 0C (773 K), 650 0C (923 K) и 800 0С (1073 К).
Результаты представлены в таблице 4.
Таблица 4.
| T, К | 
| 
| 
| 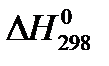 ,
кДж/моль ,
кДж/моль
|  ,
кДж/моль*К ,
кДж/моль*К
| 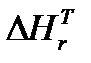 ,
кДж/моль ,
кДж/моль
| 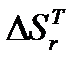 ,
кДж/моль*К ,
кДж/моль*К
|  ,
кДж/моль ,
кДж/моль
|
| 15,21 | -0,04556 | -247000 | 100,85 | 175,63 | -7366,7 | 175,51 | -7476 | |
| -14703,5 | 171,7 | -14836,2 | ||||||
| -24064,4 | 167,4 | -24218,9 | ||||||
| -35461 | 162,8 | -35635,7 |
2.4 Построение графика зависимости T=f(∆G)



Рис. 2. График зависимости T=f(∆G)
На ход реакции оказывает влияние совокупности двух факторов: фактор изменения энтальпии  и фактор изменения энтропии
и фактор изменения энтропии  .
.
Существует три возможных комбинации:
1. Реакция протекает в сторону уменьшения энтальпии и увеличения энтропии  . В подобных случаях изменение изобарно изотермического потенциала (энергии Гиббса) много меньше нуля
. В подобных случаях изменение изобарно изотермического потенциала (энергии Гиббса) много меньше нуля  . Для таких реакций характерно бурное и необратимое протекание.
. Для таких реакций характерно бурное и необратимое протекание.
2. Один из факторов благоприятен, другой нет:  и
и  :
:
a) Изменение энергии Гиббса отрицательно - реакция протекает, но как правило не полностью до состояния равновесия;
b) Реакция протекает без изменения энергии Гиббса - в данном случае в системе равновесие;
c) Изменение энергии Гиббса положительно - протекает обратная реакция.
3. Оба фактора неблагоприятны:  - в данном случае изменение энергии Гиббса много больше нуля. Такой процесс запрещен законами термодинмики.
- в данном случае изменение энергии Гиббса много больше нуля. Такой процесс запрещен законами термодинмики.
Расчеты для данных температур дают результаты, подходящие под случай 2а.
ЗАКЛЮЧЕНИЕ
В данной курсовой работе был определен расход воздуха, объем продуктов сгорания и вычислен изобарно-изотермический потенциал (энергия Гиббса) при температурах 350, 500, 650, 800 0С. Построена графическая зависимость T=f(∆G), из которой наглядно видно, что изменение энергии Гиббса отрицательно - реакция протекает, но, как правило, не полностью до состояния равновесия.
Список используемой литературы
1. Д.А. Диомидовский «Металлургические печи цветной металлургии», 1970;
2. А.А. Равдель, А.М. Пономарева «Краткий справочник физико-химических величин», 2003;
3. В.В. Нащокин «Техническая термодинамика», 1975;
4. В.Н. Зубарев «Практикум по технической термодинамике», 1986.