РЕШЕНИЯ
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Задание 1.
Атомная масса элемента Х по массовой доле кислорода в его оксиде:
XOn/2 w(O) = 0,1231
8n/(M(X) + 8n) = 0,1231
M(X) = 57n (нет разумных вариантов, для индия (n = 2) степень окисления +2 нехарактерна)
Из стандартных оксидов металлов таким способом не «перебирается» смешанновалентный оксид M3O4, встречающийся для железа, кобальта, марганца, свинца и некоторых других элементов, для которых характерны степени окисления +2, +3 или +2, +4. Проверим его:
64/(3*M(X) + 64) = 0,1231
M = 152 (Eu). Для европия, названного французом Демарсе в честь своей «большой родины» Европы, действительно характерны степени окисления +3 (основная для практически всех лантаноидов) и +2 (в которой он является сильным восстановителем), таким образом, формулу оксида Eu3O4 можно подробно представить как EuO*Eu2O3
Другие оксиды европия: EuO (изоструктурен галиту NaCl) и Eu2O3, гидроксиды: Eu(OH)2 и Eu(OH)3. Из двух основных гидроксидов по закономерному ослаблению основных свойств с усилением амфотерности при увеличении степени окисления металла более растворимым является Eu(OH)2
Для описанного в условии «гидроксида» устанавливается формула Eu(OH)2*H2O
Кристаллическая структура NaCl (соответственно, EuO и халькогенида EuY) представляет собой кубическую гранецентрированную решетку с элементарной ячейкой, содержащей 4 формульных единицы вещества:

Таким образом, выражение для плотности принимает вид:
p = mячейки/Vячейки = 4*(MEu + MY)/(Na*a3)
MY = (6,5г/см3)*(6,02*1023моль-1)*(6,58*10-8см)3/4 – 152г/моль = 126,7 г/моль (Теллур)
Формула халькогенида – EuTe.
Параметр ячейки (сторона куба) складывается из двух ионных радиусов европия и двух ионных радиусов халькогена, таким образом r(Eu2+) определяется из параметра ячейки EuO как (5,14 – 2*1,36)/2 = 1,21(Å), а r(Te2-) как (6,58 – 2*1,21)/2 = 2,08 (Å)
Химическое разделение многих лантаноидов достаточно проблематично из-за чрезвычайной схожести их химического поведения, поэтому для этой цели проводят многократную перекристаллизацию их солей или переводят в летучие соединения с последующим разделением газовой хроматографией.
Реакции, описанные в условии:
4Eu + 3O2 = 2Eu2O3
Eu + 2H2O = Eu(OH)2, постепенно происходит окисление и до Eu(+3)
2Eu(OH)2*H2O = 2Eu(OH)3 + H2↑
2Eu3O4 + 18HCl = 6EuCl3 + 8H2O + H2↑
1. Определение европия 2 балла, происхождение названия 1 балл – всего 3 балла
2. 3 формулы по 1 баллу – всего 3 балла
3. Определение теллура – 3 балла
4. 2 формулы и вердикт о растворимости по 1 баллу – всего 3 балла
5. 2 ионных радиуса по 2 балла – всего 4 балла
6. Метод разделения – 1 балл
7. 4 реакции по 2 балла – всего 8 баллов
Задание 2.
1. Газом с молярной массой 29*1,52 = 44 г/моль, скорее всего, является СО2 (предположить из какого плава при его кислотной обработке может выделиться N2O весьма проблематично, т.к. соли, содержащие азот (+1), термически неустойчивы), его количество равно 0,025 моль.
Белым осадком, образующимся при добавлении HCl, может быть либо нерастворимый хлорид (AgCl, PbCl2), либо нерастворимая кислота (H2SiO3, при прокаливании дает SiO2)
Массе 1,500г соответствуют n(AgCl) = 0,01047 моль, n(PbCl2)= 0,005394 моль, n(SiO2)= 0,025 моль. Последнее значение удачно совпадает с количеством CO2.
n(NaOH*H2O) = 7,0/58 = 0,12 (моль)
Остатком после упаривания, по-видимому, является NaCl, n(NaCl) = 7,05/58,5 = 0,12 (моль), что в точности соответствует количеству исходного моногидрата NaOH.
Совокупность имеющейся информации позволяет предположить, что плав содержит карбонат и силикат натрия в мольном соотношении 1:1, а исходное вещество Х – SiC (карбид кремния, действительно названный в честь первооткрывателя фтора Анри Муассана - муассанит),
n(SiC) = 1,000/40 = 0,025 (моль), что закрепляет эту версию как окончательную.
2. SiC + 4NaOH*H2O =(t °C) Na2SiO3 + Na2CO3 + 4H2↑ + 2H2O↑,
в ходе побочных реакций также могут выделяться CO2 (разложение карбоната с образованием ортосиликата) и СО (неполное окисление углерода)
3. По уравнению реакции видно, что для полного окисления углерода нужна вода как источник дополнительных протонов, поэтому удобнее ее сразу вводить в реакцию в составе моногидрата щелочи.
4. Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
Na2CO3 + 2HCl = H2O + CO2↑ + 2NaCl
NaOH + HCl = NaCl + H2O (щелочь в избытке!)
H2SiO3 =(t °C) H2O↑ + SiO2
Карбид кремния получают сплавлением его оксида с избытком графита при температуре выше 2000°C, получение его из простых веществ невозможно при сплавлении, а возможно только через электродуговое испарение их смеси из-за высокой прочности их кристаллических решеток.
SiO2 + 3C =(t °C) SiC + 2CO↑
1. Определение формулы минерала 5 баллов, название 2 балла, происхождение названия 1 балл – всего 8 баллов.
2. Уравнение реакции 3 балла, побочные продукты 1 балл – всего 4 балла
3. Пояснение необходимости наличия воды – 1 балл
4. 4 реакции по 2 балла, получение SiC 4 балла – всего 12 баллов
Задание 3.
1. Из экспериментов Туна видно, что А и Е – продукты последовательного окисления гидроксиламина, причем дальнейшее окисление Е приводит к образованию азотистой кислоты. Следовательно, речь идет о соединениях азота, степени окисления которого и в А и в Е ниже, чем в азотистой кислоте (+3), но выше, чем в гидроксиламине (-1). Самая низкая степень окисления азота в кислоте А, нагревание серебряной соли которой в уксусной кислоте приводит к выделению газа Б с плотностью 1,83 г/л, что соответствует молярной массе М = ρRT/P = 1,83·0,082·293/1 = 44 г/моль. Газообразное соединение азота с такой молярной массой – N2O – оксид азота(I). Поскольку про другие азотсодержащие продукты в этой реакции ничего не сказано, то и в А наиболее вероятная степень окисления азота +1. Можно было бы заподозрить, что под А скрывается азидоводородная кислота, тем более, что плотность азидоводорода HN3 при этих условиях имеет близкое значение 1,79 г/л. Однако способность А давать кислые соли не позволяет выбрать эту гипотезу.
Итак, А – двухосновная кислота со степенью окисления азота +1, что позволяет приписать ей формулу H2N2O2. Тогда для кислоты Е остается только степень окисления +2 и чтобы сохранить за азотом возможность образования трех ковалентных связей, ее формулу, так же как и для А, следует писать удвоенной: H2N2O3 (H4N2O4). В реакции 3 получается газ В и еще одна кислота Г, которая образует две таутомерные формы в растворе. Это уже хорошо всем знакомая азотистая кислота. Поскольку соляная кислота не является окислителем, это значит, что А подверглась диспропорционированию и тогда газ В – это азот. В таком случае реакция 4 – это тоже диспропорционирование, но уже не до азотистой, а до азотной кислоты (Д).
А – H2N2O2 – азотноватистая кислота, Б – N2O – оксид азота(I), В – N2 – азот, Г– HNO2 – азотистая кислота, Д – HNO3 – азотная кислота, Е – H2N2O3 (H4N2O4) – нитроксиловая кислота. Структурные формулы этих веществ:

2. Уравнения реакций:
[1]. 2NaNO2 + 4Na(Hg) + 2H2O = Na2N2O2 + 4NaOH;
[2]. Ag2N2O2 + 2CH3COOH = 2CH3COOAg + N2O↑ + H2O;
[3]. 3Ag2N2O2 + 6HCl = 6AgCl + 2N2 ↑ + 2HNO2 + 2H2O;
[4]. 5Ag2N2O2 + 10HCl = 10AgCl + 4N2 ↑ + 2HNO3 + 4H2O;
[5]. 2NH2OH + 4KMnO4 + 6KOH = K2N2O2 + 4K2MnO4 + 6H2O;
[6]. K2N2O2 + 2KMnO4 + 2KOH = K2N2O3 + 2K2MnO4 + H2O;
[7]. K2N2O3 + 2KMnO4 + 2KOH = 2KNO2 + 2K2MnO4 + H2O;
[8]. (NH3OH)HSO4 + NaNO2 = N2O↑ + NaHSO4 + 2H2O;
[9]. (NH3OH)HSO 4 + NaNO2 = H2N2O2 + NaHSO4 + H2O;
[10]. H2N2O2 = H2O + N2O↑;
[11]. 5H2N2O2 + 8KMnO 4 + 14HNO3 = 8KNO3 + 8Mn(NO3)2 + 12H2O;
[12]. H2N2O2 + 4KMnO4 + 6KOH = 2KNO2 + 4K2MnO4 + 4H2O;
[13]. H2N2O2 + HNO2 = N2 ↑ + HNO3 + H2O или H2N2O2 + 2HNO2 = 4NO↑ + 2H2O.
1. По 1 баллу за структурную формулу, по 0,5 балла за формулу и название для 6 веществ – всего 12 баллов.
2. По 1 баллу за уравнение реакции – всего 13 баллов.
Задание 4.
1. Уравнения реакций самоионизации:
N2O4 ⇄ NO+ + NO3-
N2O5 ⇄ NO2+ + NO3-
2. Из описания свойств газа Х следует, что это NO. Синий цвет раствора, который получился при взаимодействии меди с азотной кислотой, однозначно указывает на присутствие нитрата меди (II), т.е. А = Cu(NO3)2∙2.5H2O, тогда безводная соль D = Cu(NO3)2. Согласно данным элементного анализа основной соли, n(Cu): n(N) = 52.9 / 63.5: 5.8 / 14 = 0.83: 0.41 = 2: 1. Разумно предположить, что азот входит в состав В в виде нитратной группы, тогда формулу соли В можно представить в виде Cu2NO3(OH)k. Т.к. при разложении Cu(NO3)2∙2.5H2O удаление меди в виде летучих соединений исключено, то из 2 моль Cu(NO3)2∙2.5H2O образуется 1 моль Cu2NO3(OH)k, откуда молярная масса основной соли B 2 ∙ 232.5 ∙ 0.516 = 240 г/моль, k = (240 – 127 – 62)/17 = 3, т.е. В = Cu2NO3(OH)3. Для оксида С получаем n(Cu): n(O) = 79.9 / 63.5: 20.1 / 16 = 1.26: 1.26 = 1: 1, т.е. С = CuO. С учетом уравнения диссоциации NO2 можно предположить, что в состав Y входят ионы NO+ и NO3-. В этом случае формула CuN4O10 может быть представлена единственным образом: NO[Cu(NO3)3].
На основании данных о составе Z: n(Zr): n(N) = 20.4 / 91.2: 18.8 / 14 = 0.22: 1.34 = 1: 6. Учитывая аналогию Y и Z, можно ожидать, что на формульную единицу Z приходится один атом циркония, тогда молярную массу Z можно оценить как 91.2 / 0.204 = 447.06 г/моль. Исходя из условия задачи, Z содержит только Zr, N и O, т.е. формула Z может быть записана в виде ZrN6Om, откуда m = (447.06 – 91.2 – 84) / 16 = 17, т.е. Z = ZrN6O17. Рассуждая аналогичным образом, Z включает ионы NO2+ и NO3-, откуда формула ZrN6O17 может быть представлена как NO2[Zr(NO3)5]. Безводным нитратом Е является Zr(NO3)4
3. Уравнения указанных в задаче реакций могут быть записаны следующим образом
6Cu + 16HNO3 (30%) + 7H2O = 6Cu(NO3)2∙2.5H2O + 4NO↑
2NO + O2 = 2NO2
8Cu(NO3)2∙2.5H2O =(t °C) 4Cu2NO3(OH)3 + 12NO2↑ + 3O2↑ + 14H2O↑
4Cu2NO3(OH)3 =(t °C) 8CuO + 4NO2↑ + O2↑ + 6H2O↑
Cu + 3N2O4 = NO[Cu(NO3)3] + 2NO↑
NO[Cu(NO3)3] =(t °C) Cu(NO3)2 + 2NO2↑
ZrCl4 + 5N2O5 = NO2[Zr(NO3)5] + 4NO2Cl↑
2NO2[Zr(NO3)5] =(t °C) 2Zr(NO3)4 + 4NO2↑ + О2 ↑
4. В структуре N2O4 присутствует связь N–N. При изображении структурных формул необходимо учесть, что максимальная валентность атома азота равна 4.

1. 2 уравнения реакций по 2 балла – всего 4 балла
2. Формулы для 7 веществ по 1 баллу, состав ионов для двух солей по 1 баллу – всего 11 баллов
3. 8 уравнений реакций по 1 баллу – всего 8 баллов
4. 2 структурные формулы по 1 баллу – всего 2 балла
Задание 5.
1. Для сильных электролитов (HCl, KOH) pH перехода окраски (на примере лакмуса) можно определить, исходя из концентрации раствора. На 1 г HCl приходится 50000 г воды, тогда в 1 л раствора содержится 1:50:36,45 = 5,48×10-4 (моль HCl).
[H+ ] = 5,48×10-4; pH = -lg[H+ ] = 3,26.
Для красного лакмуса:
[KOH] = 1:20:56 = 8,93×10-4; [OH-] =8,93×10-4; pOH = -lg[OH-] = 3,05; pH = 14 – pOH= 10,95.
Для слабых электролитов (NH3) и электролитов средней силы (H2SO4 по второй стадии) при таких концентрациях степень диссоциации близка к 1, тогда для аммиака:
[NH3] » [OH- ] = 1:60:17 = 9,80×10-4; pOH = -lg[OH- ] = 3,01. pH = 14 – pOH = 10,99.
В случае серной кислоты [H+ ] = 2[H2SO4] = 1:49:40 = 5,10×10-4. pH = -lg[H+ ] = 3,29.
Аналогичные расчеты могут быть выполнены и для других индикаторов (см. таблицу).
| Реактивная бумага из: | pH перехода | |||
| SO3 | HCl | KOH | NH3 | |
| Лакмуса (синяго) | 3,29 | 3,20 | ||
| «(краснаго) | 10,95 | 10,99 | ||
| Куркумы | 10,99 | 11,23 | ||
| Георгины | 2,59 | 2,56 | 11,35 | 11,46 |
| Черники | 11,47 | 11,59 | ||
| Кошенили | 2,59 | 2,56 | ||
| Фенолфталеина | 10,95 | |||
| Конго краснаго | 3,09 | 3,04 |
2. Для георгина окраска от рН: Красная < 2,56 – 2,59 < голубая < 11,35 – 11,46 < зеленая
3. Для получения 100 мл 1 М раствора NaHCO3 потребуется 0,1 моль гидрокарбоната натрия – 8,4 г. В водном растворе гидрокарбоната устанавливаются равновесия:
CO32- + H3O+ ⇄ HCO3- + H2O ⇄ H2CO3 + OH-
Для процесса
HCO3- + H2O ⇄ H2CO3 + OH- K = Kw/K1a, а для процесса
HCO32- + H2O ⇄ CO3 2- + H3O+ K = K2a
Оценочное значение рН данного раствора будет равно pH = ½(K1a + K2a) = 8,32 (слабощелочная среда). Окраска индикатора георгина в этом растворе будет голубая.
4. При нагревании раствора гидрокарбоната образуется карбонат:
2NaHCO3 = Na2CO3 + H2O + CO2
Получится 0,5 М раствор карбоната натрия. В водном растворе устанавливается равновесие: CO32- + H2O ⇄ HCO3- + OH- K = Kw/K2a = [HCO3-][OH-]/[CO32-] = [OH-]2/[CO3 2-]
pK = 14 – pK2a = 2pOH + lg[CO32-]
2pOH = 3,47; pH = 14 – pOH = 12,26
Среда полученного раствора карбоната – щелочная, окраска георгинового индикатора – зеленая.
5. При добавлении раствора гидросульфата натрия к раствору карбоната натрия будет происходить реакция: CO32- + HSO4- → HCO3- + SO42- или CO32- + H3O+ → HCO3- + H2O
Пусть 10х мл раствора NaHSO4 надо прибавить к раствору карбоната, чтобы рН раствора достиг граничного значения (11,46 – 11,35), тогда для процесса:
CO32- + H2O = HCO3- + OH- K = Kw/K2a = [HCO3-][OH-]/[CO32-]
10-3,67 = (х/(0,5-х))*10-2,54 (рН=11,46)
10-3,67 = (х/(0,5-х))*10-2,65 (рН=11,35)
Для достижения рН = 11,46 (х = 0,04) необходимо добавить 10х = 0,40 мл 1 М раствора NaHSO4, а для рН = 11,35 (х = 0,05) – 0,50 мл (переход окраски из зеленой в голубую). Дальнейшее добавление гидросульфата:
HCO3- + HSO4- → SO42- + H2O + CO2
приводит к образованию нейтрального раствора сульфата натрия (10 мл добавленного раствора NaHSO4). Дальнейшее добавление гидросульфата приводит к уменьшению рН раствора за счет процесса диссоциации гидросульфат-иона:
HSO4- + H2O = SO42- + H3O+
K2a = [SO4 2-][H+ ]/[HSO4 - ]
10-1,9 = 10-2,56x/(1-x) (pH = 2,56)
10-1,9 = 10-2,59x/(1-x) (pH = 2,59)
x = 0,82 (pH = 2,56)
x = 0,83 (pH = 2,59)
После нейтрализации карбоната надо добавить 20 * 0,82 = 16,4 (16,6) мл 1 М раствора гидросульфата для перехода окраски в красную. Общий объем добавленного раствора составит 26,4 – 26,6 мл.
Задание 6.
1. Поскольку X реагирует с кальцием, следовательно, он является неметаллом. Растворение X в щёлочи сопровождается образованием растворимой соли и газа, причем элемент Х входит в состав каждого из веществ, следовательно имеет место реакция диспропорционирования, тогда газ В – водородное соединение элемента Х. Среди газов, выделяющихся из щелочного раствора известны углеводороды, силан, аммиак и фосфин; углерод и азот со щёлочью не взаимодействуют, кремний не диспропорционирует, таким образом элемент Х – фосфор. Критически оценивая всю схему целиком через призму сделанного предположения, находим, что превращение С → X отвечает промышленному способу получения фосфора, что подкрепляет вывод, сделанный на основании рассуждений изложенных выше. Таким образом, X = P4, A = NaH2PO2, B = PH3, С = Ca3(PO4)2, D = Ca3P2, E = P4O10, F = Na2HPO3, G = (NH4)2PO3F
2. Уравнения проведенных реакций:
P4 + 3NaOH + 3H2O → 3NaH2PO2 + PH3
P4 + 6Ca → 2Ca3P2
2NaH2PO2 + 4CaOCl2 → Ca3(PO4)2↓ + CaCl2 + 2NaCl + 4HCl
2Ca3(PO4)2 + 10C + 6SiO2 → 6CaSiO3 + 10CO↑ + P4↑
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
Ca3P2 + 6HCl → 3CaCl2 + 2PH3↑
2Ca3(PO4)2 + 6SiO2 → 6CaSiO3 + P4O10↑
3NaH2PO2 → Na2HPO3 + NaH2PO3 + PH3↑
P4O10 + 8NH4F + 2H2O → 4(NH4)2PO3F + 4HF
В качестве черного осадка, образующегося при взаимодействии NaH2PO2 и AgNO3, может выступать только металлическое серебро (продукт восстановления окислителя). В качестве продуктов окисления NaH2PO2 могут быть H3PO3, либо H3PO4:
NaH2PO2 + 2AgNO3 + H2O → NaNO3 + HNO3 + H3PO3 + 2Ag↓
(NaH2PO2 + 4AgNO3 +2H2O → NaNO3 + 3HNO3 + H3PO4 + 4Ag↓ при нагревании р-ра)
Na2HPO3 + 2AgNO3 → Ag2HPO3↓ (белый осадок)
Ag2HPO3 + H2O →(τ) H3PO4 + 2Ag (черный осадок)
Взаимодействие фосфора с избытком хлора приводит к PCl5, а с недостатком – к PCl3:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
3. Структура X, E, анионов F, C и G:
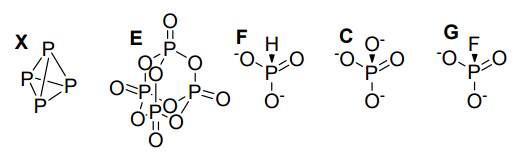
Веществом X является именно белый фосфор, молекула которого имеет структуру тетраэдра, в вершинах которого расположены атомы фосфора. Анион РО43- – правильный тетраэдр с углом О–Р–О равным тетраэдрическому. Согласно теории отталкивания электронных пар валентной оболочки, меньшее отталкивание испытывают валентные пары, связывающие центральный атом с более электроотрицательным атомом. Следовательно, в анионе РО3F2–, содержащим фтор, взаимное отталкивание пар Р–О сильнее взаимодействия пар P–F и Р–О, что приводит к увеличению валентного угла О–Р–О по сравнению с РО43-. Таким образом, угол О–Р–О в анионе РО3F2– больше тетраэдрического 109.5°
1. 8 формул по 0,75 балла – всего 6 баллов
2. 11 уравнений реакций по 1 баллу – всего 11 баллов
3. 5 структур по 1 баллу, 2 вывода о валентных углах по 1,5 балла – всего 8 баллов
ФИЗИЧЕСКАЯ ХИМИЯ
Задача ФХ-1 (автор Д. М. Жилин)
1) Запишем уравнения реакций. Окислителями могут быть O2 и N2O, горючими –
все остальные газы.
а) 2 H2 + O2 = 2 H2O
б) CH4 + 2 O2 = CO2 + 2 H2O
в) 2 C4H10 + 13 O2 = 8 CO2 + 10 H2O
г) H2 + N2O = H2O + N2
д) CH4 + 4 N2O = CO2 + 2 H2O + 4 N2
е) C4H10 + 13 N2O = 4 CO2 + 5 H2O + 13 N2
Рассчитаем тепловые эффекты реакций по закону Гесса: сумма теплот образования
продуктов минус сумма теплот образования реагентов. Учтём, что теплоты образования
простых веществ равны нулю.
Чтобы сравнить количество теплоты q в расчёте на единицу объёма исходной
смеси, достаточно сравнить тепловой эффект Q в расчёте на один моль исходной смеси, то
есть q = Q /S1, где S1 – сумма коэффициентов перед реагентами.
Результаты расчётов представлены в таблице.

Таким образом, больше всего теплоты в расчёте на единицу объёма исходной смеси
выделится при реакции бутана с кислородом.
2) Чтобы узнать объём продуктов сгорания в расчёте на объём реагентов,
достаточно найти соотношение сумм коэффициентов при продуктах S2 и при реагентах S1:
а) 2 / (1 + 2) = 0.67
б) (2 + 1) / (1 + 2) = 1
в) (8 + 10) / (2 + 13) = 1.2
г) (1 + 1) / (1 + 1) = 1
д) (1 + 2 + 4) / (1 + 4) = 1.4
е) (4 + 5 + 13) / (1 + 13) = 1.57
Максимальное увеличение объёма будет наблюдаться при реакции C4H10 с N2O.
3) Масса продуктов равна массе исходных веществ. Масса исходных веществ на
единицу их объема – это плотность, которая прямо пропорциональна средней молярной
массе  : чем она больше, тем больше масса продуктов на единицу
: чем она больше, тем больше масса продуктов на единицу
объёма.
а) (2 · 2 + 32) / 3 = 12.0 г/моль
б) (16 + 2 · 32) / 3 = 26.7 г/моль
в) (2 · 58 + 13 · 32) / 15 = 35.5 г/моль
г) (2 + 44) / 2 = 23.0 г/моль
д) (16 + 4 · 44) / 5 = 38.4 г/моль
е) (58 + 13 · 44) / 14 = 45.0 г/моль
Таким образом, максимальная масса на единицу объёма образуется при сгорании
смеси C4H10 с N2O.
4) Тяга есть произведение скорости выброса массы D m /D t на скорость выброса
струи газа v. Если скорость сгорания смесей одинакова, то масса, выбрасываемая в
единицу времени, пропорциональна плотности (средней молярной массе) исходной
газовой смеси (пункт 3).
Скорость выброса пропорциональна корню из теплового эффекта в расчёте на
1 моль реагентов (пункт 1). Перемножим эти два фактора:
а) 12 ·1611/2 = 152
б) 26.7 · 2671/2 = 436
в) 35.5 · 3541/2 = 668
г) 23 · 1621/2 = 293
д) 38.4 · 2261/2 = 577
е) 45 · 2661/2 = 734
Таким образом, наибольшую тягу обеспечит смесь C4H10 с N2O.
Возможны другие разумные предположения при оценке того, какая смесь даст
максимальную тягу.
5) Ту, которая даст наибольшую тягу, то есть C4H10 с N2O.
Система оценивания:
1. За верный расчёт для каждой смеси по 1 баллу, или за правильный результат, полученный с помощью оценок 6 баллов
2. За верный расчёт для каждой смеси по 1 баллу, или за правильный результат, полученный с помощью оценок 6 баллов
3. За верный расчёт для каждой смеси по 1 баллу, или за правильный результат, полученный с помощью оценок 6 баллов
4. За верный расчёт для каждой смеси по 1 баллу, или за правильный результат, полученный с помощью оценок 6 баллов
5. За верный ответ 1 балл
Итого 25 баллов.
Итого 25 баллов