1. Из молекулярной формулы и отмеченных химических свойств понятно, что B – циклопентадиен, а A – его димер (B образуется из А в результате процесса, обратного реакции Дильса-Альдера). Под действием сильного основания циклопентадиен легко депротонируется; образовавшийся анион проявляет нуклеофильные свойства и реагирует с алкилгалогенидом, замещая галогенид-ион:
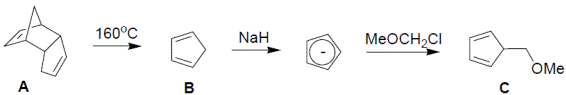
Образовавшееся соединение С вступает в реакцию Дильса-Альдера с α-хлоракрилонитрилом. Цианогруппа гидролизуется водной щелочью относительно медленно, зато активирует нуклеофильное замещение хлорид-иона с образованием циангидрина, который в условиях реакции неустойчив и расщепляется с образованием кетона Е.

Далее кетон Е окисляют м -хлорнадбензойной кислотой. При этом образуются два изомера состава С9Н12О3. Поскольку при обработке Е щелочным раствором Н2О2 образуется только один из них, а реакция с CF3CO3H ведет к другому, можно понять, что эти два изомера образуются различными путями, т.е. не являются стереоизомерами. Так как формула Е имеет вид С9Н12О2, один из них, очевидно, является эпоксидом; другой – продуктом окисления кетона по Байеру-Виллигеру. Для эпоксидирования по Прилежаеву, как известно, используются надкислоты, т.е. G – эпоксид. Следовательно, F – циклический сложный эфир (лактон).

Лактон F гидролизуется при действии водного раствора щелочи; при действии на продукт I2 происходит иодолактонизация. Две стадии превращения образовавшегося лактона в J очевидны: (CH3CO)2O ацетилирует OH группу; удаление метильной группы (–CH2OMe → –CH2OH) протекает при действии BBr3. Тогда n -Bu3SnH в сочетании с радикальным инициатором используется для удаления из молекулы иода:

Бициклический продукт J окисляется действием CrO3 до альдегида К, после чего вступает в реакцию Виттига с образованием енона L. Восстановление последнего боргидридом цинка дает диастереомеры состава С17Н26О5. Из структур L и PGF2 α можно сделать вывод, что М – изомерные аллиловые спирты, причем конфигурация ОН группы в М1 та же, что в PG.

Обработка М1 карбонатом калия, очевидно, ведет к гидролизу сложного эфира. В М1 имеется две сложноэфирных группы: алкилацетат и лактон. Обе они могут подвергаться гидролизу. Поскольку дальнейшие превращения, ведущие к простагландинам, затрагивают лактон, можно сделать вывод, что при действии K2CO3 происходит селективный гидролиз группы ROAc с образованием соответствующего спирта (гидролиз более затрудненного лактона протекает существенно медленнее). Далее при действии i -Bu2AlH лактон восстановливается в альдегидную группу, которая подвергается реакции Виттига. Из структуры PGF2 α видно, что в последнюю реакцию вступает альдегид, образующийся именно из лактонового фрагмента. Чтобы альдегид не взаимодействовал со спиртовыми группами (после гидролиза М1 молекула представляет собой диол) с образованием ацеталя или полуацеталя, эти группы защищают действием дигидропирана в присутствии кислотного катализатора. После проведения реакции Виттига тетрагидропиранильную защиту снимают обработкой кислотой. Таким образом, оставшиеся стадии в синтезе PG имеют вид:

2. При комнатной температуре происходит быстрая изомеризация моноалкилзамещенного циклопентадиена с образованием смеси из трех продуктов:

3.

Система оценивания:
1. Структуры А – С и М1-М2 по 1 баллу, структуры D-L, N, O и PGE2 по 1,5 балла. Всего 23 балла.
2. 1 балл
3. 1 балл
Всего 25 баллов.
ХИМИЯ И ЖИЗНЬ