8.4.1. Как уже отмечалось, ферменты, относятся к катализаторам, активность которых может регулироваться. Поэтому через ферменты можно контролировать скорость протекающих химических реакций в организме. Регуляция активности ферментов может осуществляться путем взаимодействия с ними различных биологических компонентов или чужеродных соединений (например, лекарств и ядов), которые принято называть модификаторами или регуляторами ферментов. Под действием модификаторов на фермент реакция может ускоряться (в этом случае их называют активаторами) или замедляться (в этом случае их называют ингибиторами).
8.4.2. Активация ферментов определяется по ускорению биохимических реакций, наступающему после действия модификатора. Одну группу активаторов составляют вещества, влияющие на область активного центра фермента. К ним относятся кофакторы ферментов и субстраты. Кофакторы (ионы металлов и коферменты) являются не только обязательными структурными элементами сложных ферментов, но и по существу их активаторами.
Из ионов металлов на активность многих ферментов влияют: NH4+, Na+, Mg2+, K+, Ca2+, Mn2+, Zn2+, Fe2+, Fe3+, Co2+. Ионы тяжелых металлов, как правило, оказывают ингибирующее влияние. Действие катионов в основном довольно специфично, но в большинстве случаев фермент активируется более, чем одним катионом. Наблюдается также явление антагонизма между ионами. Наиболее известен антагонизм между Na+ и К+ и между Mg2+ и Са2+.
Магний является природным активатором ферментов, действующих на фосфорилированные субстраты (фосфатазы, киназы, синтетазы), но в условиях in vitro может быть заменён марганцем.
Анионы в общем мало влияют на активность ферментов, и их воздействие лишено специфичности. Исключением является амилаза, активируемая хлоридами, а также, в меньшей степени, другими галогенами. Влияние активирующего иона изменяется также в зависимости от рН. Степень очистки фермента также влияет на активирующую концентрацию иона и на специфичность активации. Высокоочищенные ферменты характеризуются большей избирательностью по отношению к активирующим ионам.
8.4.3. Активирующее действие ионов металлов реализуется различными путями. Наиболее типичным механизмом является включение иона в структуру каталитического центра фермента, который без него не проявляет активности. Это типичная функция металла в роли кофермента. Другой, довольно частой функцией активирующего металла является образование связи между ферментом и субстратом, или между ферментом, коферментом и субстратом. Например, ионы Zn2+ в составе фермента алкогольдегидрогеназы образуют 2 координационные связи с молекулой кофермента НАД+, 3 координационные связи с молекулой апофермента, а шестая координационная связь присоединяет субстрат.
Ионы металлов, так же как и субстраты, коферменты, их предшественники и структурные аналоги, можно использовать на практике в качестве препаратов, регулирующих активность ферментов.
Если каталитически активный белок называется ферментом (или энзимом), то неактивный предшественник фермента называется проферментом (или зимогеном).
Активация белков путем частичного протеолиза - процесс, широко распространенный в биологических системах. Вот несколько примеров.
· пищеварительные ферменты, гидролизующие белки, синтезируются в желудке и поджелудочной железе в виде проферментов: пепсин – в виде пепсиногена, трипсин – в виде трипсиногена и т.д.
· свертывание крови представляет собой каскад реакций протеолитической активации проферментов. Это обеспечивает быструю ответную реакцию на повреждение кровеносного сосуда.
· некоторые белковые гормоны синтезируются в виде неактивных предшественников. Например, инсулин образуется из проинсулина.
· фибриллярный белок соединительной ткани коллаген также образуется из предшественника — проколлагена.
15. Принципы количественного определения ферментов. Единицы активности ферментов. Основные направления использования ферментов в медицине. Энзимодиагностика, энзимотерапия, использование ферментов как реагентов.
Уникальное свойство ферментов ускорять химические реакции может быть использовано для количественного определения содержания этих биокатализаторов в биологическом материале (тканевом экстракте, сыворотке крови и т.д.). При правильно подобранных экспериментальных условиях почти всегда существует пропорциональность между количеством фермента и скоростью катализируемой реакции, поэтому по активности фермента можно судить о количественном содержании его в исследуемой пробе.
Измерение ферментативной активности основывается на сравнении скорости химической реакции в присутствии активного биокатализатора со скоростью реакции в контрольном растворе, в котором фермент отсутствует или инактивирован.
Исследуемый материал помещают в инкубационную среду, где созданы оптимальные температура, рН среды, концентрации активаторов и субстратов. Одновременно осуществляют постановку контрольной пробы, в которую фермент не добавляют. Спустя некоторое время реакцию останавливают путём добавления различных реагентов (изменяющих рН среды, вызывающих денатурацию белков и т.д.) и проводят анализ проб.
Для того чтобы определить скорость ферментативной реакции, необходимо знать:
· разность концентраций субстрата или продукта реакции до и после инкубации;
· время инкубации;
· количество материала, взятое для анализа.
Наиболее часто активность фермента оценивают по количеству образовавшегося продукта реакции. Так поступают, например, при определении активности аланинаминотрансферазы, катализирующей следующую реакцию:
Определяя содержание одного из продуктов реакции – пировиноградной кислоты – в пробе после инкубации и вычитая из этого значения количество пировиноградной кислоты в контрольной пробе (в неё исследуемый материал добавляется после инкубации), находят количество продукта реакции, образовавшегося за время инкубации.
Активность фермента можно рассчитывать также исходя из количества израсходованного субстрата. В качестве примера можно привести способ определения активности α-амилазы – фермента, расщепляющего крахмал. Измерив содержание крахмала в пробе до и после инкубации и вычислив разность, находят количество субстрата, расщеплённого за время инкубации.
Существует большое количество методов измерения активности ферментов, различающихся по технике исполнения, специфичности, чувствительности.
Чаще всего для определения применяются фотоэлектроколориметрические методы. В основе этих методов лежат цветные реакции с одним из продуктов действия ферментов. При этом интенсивность окраски получаемых растворов (измеренная на фотоэлектроколориметре) пропорциональна количеству образовавшегося продукта. Например, в процессе реакций, катализируемых аминотрансферазами, накапливаются α-кетокислоты, которые дают с 2,4-динитрофенилгидразином соединения красно-бурого цвета:
Если исследуемый биокатализатор обладает низкой специфичностью действия, то можно подобрать такой субстрат, в результате реакции с которым образуется окрашенный продукт. Примером может служить определение щелочной фосфатазы – фермента, широко распространённого в тканях человека, его активность в плазме крови существенно меняется при заболеваниях печени и костной системы. Этот фермент в щелочной среде гидролизует большую группу фосфорнокислых эфиров, как природных, так и синтетических. Одним из синтетических субстратов является паранитрофенилфосфат (бесцветный), который в щелочной среде расщепляется на ортофосфат и паранитрофенол (жёлтого цвета).
За ходом реакции можно наблюдать, измеряя постепенно нарастающую интенсивность окраски раствора:
Для ферментов, обладающих высокой специфичностью действия, такой подбор субстратов, как правило, невозможен.
Спектрофотометрические методы основаны на изменении ультрафиолетового спектра химических веществ, принимающих участие в реакции. Большинство соединений поглощает ультрафиолетовые лучи, причём поглощаемые длины волн характерны для присутствующих в молекулах этих веществ определённых групп атомов. Ферментативные реакции вызывают внутримолекулярные перегруппировки, в результате которых меняется ультрафиолетовый спектр. Эти изменения можно зарегистрировать на спектрофотометре.
Спектрофотометрическими методами, например, определяют активность окислительно-восстановительных ферментов, содержащих в качестве коферментов НАД или НАДФ. Эти коферменты действуют как акцепторы или доноры атомов водорода и, таким образом, либо восстанавливаются, либо окисляются в процессах метаболизма. Восстановленные формы этих коферментов имеют ультрафиолетовый спектр с максимумом поглощения при 340 нм, окисленные формы этого максимума не имеют. Так, при действии лактатдегидрогеназы на молочную кислоту происходит перенос водорода на НАД, что приводит к увеличению поглощения НАДН при 340 нм. Величина этого поглощения в оптических единицах пропорциональна количеству образовавшейся восстановленной формы кофермента.
По изменению содержания восстановленной формы кофермента можно определить активность фермента.
Флюориметрические методы. В основе этих методов лежит явление флюоресценции, которое заключается в том, что исследуемый объект под влиянием облучения излучает свет с более короткой длиной волны. Флюориметрические методы определения активности ферментов более чувствительны, чем спектрофотометрические. Сравнительно новыми и ещё более чувствительными являются хемилюминесцентные методы с применением люциферин-люциферазной системы. Такие методы позволяют определять скорость реакций, протекающих с образованием АТФ. При взаимодействии люциферина (карбоновой кислоты сложного строения) с АТФ образуется люцифериладенилат. Это соединение окисляется при участии фермента люциферазы, что сопровождается световой вспышкой. Измеряя интенсивность световых вспышек, удаётся определять количества АТФ порядка нескольких пикомолей (10–12 моль).
Титрометрические методы. Ряд ферментативных реакций сопровождается изменением рН инкубационной смеси. Примером такого фермента является липаза поджелудочной железы. Липаза катализирует реакцию:
Образующиеся жирные кислоты могут быть оттитрованы, причём количество щёлочи, израсходованное на титрование, будет пропорционально количеству выделившихся жирных кислот и, следовательно, активности липазы. Определение активности этого фермента имеет клиническое значение.
Манометрические методы основаны на измерении в закрытом реакционном сосуде объёма газа, выделившегося (или поглощённого) в ходе энзиматической реакции. С помощью таких методов были открыты и изучены реакции окислительного декарбоксилирования пировиноградной и α-кетоглутаровой кислот, протекающие с выделением СО2. В настоящее время эти методы используются редко.
Международная комиссия по ферментам предложила за единицу активности любого фермента принимать такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля (10–6 моль) субстрата в единицу времени (1 мин, 1 час) или одного микроэквивалента затронутой группы в тех случаях, когда атакуется более одной группы в каждой молекуле субстрата (белки, полисахариды и другие). Должна быть указана температура, при которой проводится реакция. Результаты измерений активности ферментов могут быть выражены в единицах общей, удельной и молекулярной активности.
За единицу общей активности фермента принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на количество материала, взятого для исследования. Так, активность аланинаминотрансферазы в печени крыс равна 1670 мкмоль пирувата в час на 1 г ткани; активность холинэстеразы в сыворотке крови человека составляет 250 мкмоль уксусной кислоты в час на 1 мл сыворотки при 37°C.
Особого внимания исследователя требуют высокие значения активности фермента как в норме, так и в патологии. Рекомендуется работать с небольшими показателями активности фермента. Для этого источник фермента берут в меньшем количестве (сыворотку разводят в несколько раз физиологическим раствором, а для ткани готовят меньший процентный гомогенат). По отношению к ферменту в таком случае создаются условия насыщения субстратом, что способствует проявлению его истинной активности.
Общая активность фермента рассчитывается с помощью формулы:
где а – активность фермента (общая), ΔС – разность концентраций субстрата до и после инкубации; В – количество материала, взятого на анализ, t - время инкубации; n - разведение.
Следует иметь в виду, что показатели активности ферментов сыворотки крови и мочи, исследуемых в диагностических целях, выражают в единицах общей активности.
Поскольку ферменты являются белками, важно знать не только общую активность фермента в исследуемом материале, но и ферментативную активность белка, находящегося в данной пробе. За единицу удельной активности принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на 1 мг белка пробы. Для вычисления удельной активности фермента необходимо общую активность разделить на содержание белка в пробе:
Например, содержание белка в ткани печени составляет 160 мг/г. Разделив общую активность аланинаминотрансферазы (см. выше) на это значение, получаем 10,4 мкмоль пирувата/мг белка × час.
Чем хуже очищен фермент, тем больше в пробе находится посторонних балластных белков, тем ниже удельная активность. В ходе очистки количество таких белков уменьшается, и соответственно удельная активность фермента повышается. Предположим, в исходном биологическом материале, являющемся источником фермента (измельчённая печень, кашица из растительной ткани), удельная активность была равна 0,5 мкмоль/ (мг белка× мин). После дробного осаждения сульфатом аммония и гель-фильтрации через сефадекс она повысилась до 25 мкмоль/ (мг белка× мин), т.е. увеличилась в 50 раз. К оценке эффективности очистки ферментных препаратов прибегают при производстве лекарственных средств энзиматической природы.
Удельную активность определяют в том случае, когда нужно сопоставить активность разных препаратов одного и того же фермента. Если требуется сравнить активность разных ферментов, рассчитывают молекулярную активность.
Молекулярная активность (или число оборотов фермента) – это количество моль субстрата, подвергающееся превращению под действием 1 моль фермента в единицу времени (обычно в 1 минуту). Разным ферментам присуща неодинаковая молекулярная активность. Уменьшение числа оборотов ферментов происходит под действием неконкурентных ингибиторов. Изменяя конформацию каталитического центра фермента, эти вещества понижают сродство фермента к субстрату, что приводит к уменьшению числа молекул субстрата, реагирующих с одной молекулой фермента в единицу времени.
16. Питание - составная часть обмена веществ. Основные компоненты пищевого рациона и их роль. Заменимые и незаменимые компоненты пищевого рациона. Сбалансированное питание. Последствия несбалансированного питания у детей .
Полноценным называется рацион, соответствующий энергетическим потребностям человека и содержащий необходимое количество незаменимых пищевых веществ, обеспечивающих нормальный рост и развитие организма.
Факторы, влияющие на потребность организма в энергии и питательных веществах: пол, возраст и масса тела человека, его физическая активность, климатические условия, биохимические, иммунологические и морфологические особенности организма.
Все питательные вещества можно разделить на пять классов:
1. белки; 2. жиры; 3. углеводы; 4. витамины; 5. минеральные вещества.
Кроме того, любая диета должна содержать воду, как универсальный растворитель.
Незаменимыми компонентами пищевого рациона являются:
1. незаменимые аминокислоты - валин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан;
2. незаменимые (эссенциальные) жирные кислоты - линолевая, линоленовая, арахидоновая;
3. водо- и жирорастворимые витамины;
4. неорганические (минеральные) элементы - кальций, калий, натрий, хлор, медь, железо, хром, фтор, йод и другие.
11.1.2. Сбалансированный пищевой рацион. Диета, содержащая питательные вещества в соотношении, оптимальном для максимального удовлетворения пластических и энергетических потребностей организма человека, называется сбалансированным пищевым рационом. Считается, что самым благоприятным является соотношение белков, жиров и углеводов близкое к 1:1:4, при условии что общая калорийность рациона соответствует энергозатратам данного человека. Так, для студента-юноши весом 60 кг, энергозатраты составляют в среднем 2900 ккал в сутки и рацион должен содержать: 80-100 г белков, 90 г жиров, 300 - 400 г углеводов.
17. Биологическая ценность пищевых белков. Количество и качество белков в питании человека. Заменимые и незаменимые аминокислоты. Комбинирование пищевых продуктов, взаимодополняющих по аминокислотному составу. Характеристика белковой диеты детей. Последствия недостаточного белкового питания у детей.
Биологическая роль пищевых белков заключается в том, что они служат источником незаменимых и заменимых аминокислот. Аминокислоты используются организмом для синтеза собственных белков; в качестве предшественников небелковых азотистых веществ (гормонов, пуринов, порфиринов и др.); как источник энергии (окисление 1 г белков даёт примерно 4 ккал энергии).
Пищевые белки делятся на полноценные и неполноценные.
Полноценные пищевые белки - животного происхождения, содержат в своём составе все аминокислоты в необходимых пропорциях и хорошо усваиваются организмом.
Неполноценные белки - растительного происхождения, не содержат, или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Так, зерновые культуры, дефицитны по лизину, метионину, треонину; в белке картофеля мало метионина и цистеина. Для получения полноценных по белку пищевых рационов, следует комбинировать растительные белки, дополняющие друг друга по аминокислотному составу, например, кукурузу и бобы.
Суточная потребность: не менее 50 г в сутки, в среднем 80-100 г.
11.2.2. Белковая недостаточность в детском возрасте вызывает: 1. снижение сопротивляемости организма инфекциям; 2. остановку роста вследствие нарушения синтеза факторов роста; 3. энергетическую недостаточность организма (истощение углеводных и жировых депо, катаболизм тканевых белков); 4. потерю массы тела - гипотрофию. При белковом голодании наблюдаются отеки, которые возникают вследствие снижения содержания белков в крови (гипоальбуминемии) и нарушения распределения воды между кровью и тканями.
18. Переваривание белков. Протеиназы. Механизм активации протеиназ желудочно-кишечного тракта. Специфичность (избирательность) гидролиза пептидных связей. Особенности переваривания белков удетей грудного возраста, нарушения переваривания белков у детей. Гниение белков (аминокислот) в толстом кишечнике.
Переваривание белков, то есть расщепление их до отдельных аминокислот, начинается в желудке и заканчивается в тонком кишечнике. Переваривание происходит под действием желудочного, панкреатического и кишечного соков, которые содержат протеолитические ферменты (протеазы или пептидазы). Протеолитические ферменты относятся к классу гидролаз. Они катализируют гидролиз пептидных связей СО—NН белковой молекулы.
Все протеолитические ферменты можно разделить на две группы:
1. экзопептидазы – катализируют разрыв концевой пептидной связи с освобождением N- или С-концевой аминокислоты;
2. эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи, продуктами реакции являются пептиды с меньшей молекулярной массой.
10.1.3. Большинство протеолитических ферментов, участвующих в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде неактивных предшественников – проферментов (зимогенов). Поэтому не происходит переваривания белков клеток, вырабатывающих проферменты. Активация проферментов осуществляется в просвете желудочно-кишечного тракта путём частичного протеолиза – отщепления части пептидной цепи зимогена.
Основная масса аминокислот, образовавшихся в пищеварительном тракте в результате переваривания белков, всасывается в кровь и пополняет аминокислотный фонд организма. Определённое количество невсосавшихся аминокислот подвергается гниению в толстом кишечнике.
Гниение – превращения аминокислот, вызванные деятельностью микроорганизмов в толстом кишечнике. Усилению процессов гниения аминокислот могут способствовать:
· избыточное поступление белков с пищей;
· врождённые и приобретённые нарушения процесса всасывания аминокислот в кишечнике;
· снижение моторной функции кишечника.
В результате гниения аминокислот образуются различные вещества, многие из которых являются токсичными для организма. Некоторые примеры продуктов гниения приводятся в таблице 10.2.
Таблица 10.2
Продукты гниения аминокислот в кишечнике.
| Аминокислоты | Продукты гниения | |
| Тирозин | Крезол | |
| Фенол | ||
| Триптофан | Скатол | |
| Индол | ||
| Цистеин, Метионин | Метилмеркаптан | |
| Сероводород | ||
| Лизин | Кадаверин | |
| Орнитин | Путресцин |
10.2.2. Продукты гниения аминокислот являются ксенобиотиками – веществами, чужеродными для организма человека и должны быть обезврежены (инактивированы).
Роль липидов в организме. Пищевые липиды, суточная потребность у детей разного возраста. Особенности использования липидов в различных тканях. Бурая жировая ткань. Депонирование и мобилизация жиров в жировой ткани. Ожирение.
В состав пищевых жиров входят в, основном, триацилглицеролы (98%), фосфолипиды и холестерол. Триацилглицеролы животного происхождения содержат много насыщенных жирных кислот и имеют твёрдую консистенцию. Растительные жиры содержат больше ненасыщенных жирных кислот и имеют жидкую консистенцию (масла).
Биологическая роль: 1. являются одним из основных источников энергии; 2. служат источником незаменимых полиненасыщенных жирных кислот; 3. способствуют всасыванию из кишечника жирорастворимых витаминов. Полиненасыщенные жирные кислоты необходимы организму для построения фосфолипидов, формирующих основу всех мембранных структур клетки и липопротеинов крови. Кроме того, линолевая кислота используется для синтеза арахидоновой кислоты, служащей предшественником простагландинов, простациклинов, тромбоксанов и лейкотриенов.
Суточная потребность: 90-100 г, из них 30% должны приходиться на растительные масла. Пищевая ценность растительных жиров выше, чем животных, так как при равном энергетическом эффекте - 9 ккал на 1 г, они содержат больше незаменимых жирных кислот.
11.3.2. Нарушение соотношения доли растительных и животных жиров в рационе приводит к изменению соотношения в крови различных классов липопротеинов и, как следствие, к ишемической болезни сердца и атеросклерозу.
20. Переваривание жиров. Липазы и фосфолипазы. Желчные кислоты и парные желчные кислоты: строение, образование, биологическая роль. Особенности переваривания липидов у детей. Нарушения переваривания липидов.
Основным местом переваривания липидов является верхний отдел тонкого кишечника. Для переваривания липидов необходимы следующие условия:
· наличие липолитических ферментов;
· условия для эмульгирования липидов;
· оптимальные значения рН среды (в пределах 5,5 – 7,5).
10.3.2. В расщеплении липидов участвуют различные ферменты. Пищевые жиры у взрослого человека расщепляются в основном панкреатической липазой; обнаруживается также липаза в кишечном соке, в слюне, у грудных детей активна липаза в желудке. Липазы относятся к классу гидролаз, они гидролизуют сложноэфирные связи -О-СО- с образованием свободных жирных кислот, диацилглицеролов, моноацилглицеролов, глицерола
Поступающие с пищей глицерофосфолипиды подвергаются воздействию специфических гидролаз – фосфолипаз, расщепляющих сложноэфирные связи между компонентами фосфолипидов. Специфичность действия фосфолипаз показана на рисунке 10.4.
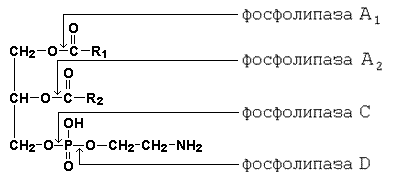
Рисунок 10.4. Специфичность действия ферментов, расщепляющих фосфолипиды.
Продуктами гидролиза фосфолипидов являются жирные кислоты, глицерол, неорганический фосфат, азотистые основания (холин, этаноламин, серин).
Пищевые эфиры холестерола гидролизуются панкреатической холестеролэстеразой с образованием холестерола и жирных кислот.
10.3.3. Уясните особенности структуры желчных кислот и их роль в переваривании жиров. Желчные кислоты – конечный продукт обмена холестерола, образуются в печени. К ним относятся: холевая (3,7,12-триоксихолановая), хенодезоксихолевая (3,7-диоксихолановая)и дезоксихолевая (3, 12-диоксихолановая) кислоты (рисунок 10.5, а). Две первые являются первичными желчными кислотами (образуются непосредственно в гепатоцитах), дезоксихолевая – вторичной (так как образуется из первичных желчных кислот под влиянием микрофлоры кишечника).
В желчи эти кислоты присутствуют в конъюгированной форме, т.е. в виде соединений с глицином Н2N-СН2-СООН или таурином Н2N-СН2-СН2-SO3H (рисунок 10.5, б).

Рисунок 10.5. Строение неконъюгированных (а) и конъюгированных (б) желчных кислот.
15.1.4. Желчные кислоты обладают амфифильными свойствами: гидроксильные группы и боковая цепь гидрофильны, циклическая структура гидрофобна. Эти свойства обусловливают участие желчных кислот в переваривании липидов:
1) желчные кислоты способны эмульгировать жиры, их молекулы своей неполярной частью адсорбируются на поверхности жировых капель, в то же время гидрофильные группы вступают во взаимодействие с окружающей водной средой. В результате снижается поверхностное натяжение на границе раздела липидной и водной фаз, вследствие чего крупные жировые капли разбиваются на более мелкие;
2) желчные кислоты наряду с колипазой желчи участвуют в активировании панкреатической липазы, сдвигая её оптимум рН в кислую сторону;
3) желчные кислоты образуют с гидрофобными продуктами переваривания жиров водорастворимые комплексы, что способствует их всасыванию в стенку тонкого кишечника.
Желчные кислоты, проникающие в процессе всасывания вместе с продуктами гидролиза в энтероциты, через портальную систему поступают в печень. Эти кислоты могут повторно секретироваться с желчью в кишечник и участвовать в процессах переваривания и всасывания. Такая энтеро-гепатическая циркуляция желчных кислот может осуществляться до 10 и более раз в сутки.
Ответы 21-40
Потребности в углеводах у детей разного возраста. Возрастная характеристика процессов переваривания и всасывания углеводов. Особенности промежуточного обмена углеводов в анте- и постнатальном периоде.
Потребность в углеводах превышает потребность в белках и жирах.
Существенных различий в потребности детей первого года жизни в углеводах при естественном и искусственном вскармливании не отмечается: на протяжении первого года жизни она составляет 12-14 г на 1 кг массы тела.
Очень важно соблюдать правильное соотношение белков, жиров и углеводов. Для детей до 1 года оно составляет 1:3:5 при естественном вскармливании и 1:2:4 при искусственном вскармливании, для детей старше года - 1:1:4.
Основным источником энергии являются углеводы. При сгорании 1 г углеводов высвобождается 4,1 ккал. Жиры удовлетворяют не менее 30% потребностей организма в энергии.
У детей грудного возраста они как источник энергии имеют еще большее значение. Так, у детей первых месяцев жизни, находящихся на грудном вскармливании, за счет жиров покрывается до 50% энергетической потребности, а в первые дни жизни-до 80-90%. При сгорании 1 г жира выделяется 9,0 ккал. Белки также могут использоваться как энергетический материал. При сгорании 1 г белка выделяется 4,0 ккал.
Лактоза, как и другие гликозидазные комплексы, связана с щёточной каемкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, активность лактазы у плода особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность фермента снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Переваривание и всасывание углеводов. Катаболизм лактозы и сахарозы. Особенности метаболизма фруктозы и галактозы. Наследственные заболевания углеводного обмена: галактоземия, непереносимость сахарозы и лактозы.
Гидролиз крахмала начинается в ротовой полости. В слюне содержится фермент амилаза, частично расщепляющая крахмал. Основное место переваривания крахмала - тонкий кишечник. Туда поступает амилаза сока поджелудочной железы. Продуктом действия амилазы является мальтоза. Мальтоза далее расщепляется с помощью мальтазы до глюкозы, дисахарид лактоза (содержащаяся в молоке) расщепляется с помощью лактазы до глюкозы и галактозы. Дисахарид сахароза (содержащаяся в пищевом сахаре) расщепляется с помощью сахаразы до глюкозы и фруктозы.
10.5.2. Продукты полного переваривания углеводов - глюкоза, галактоза и фруктоза - через клетки кишечника поступают в кровь путем облегченной диффузии и активного транспорта.
10.5.3. Основные пути метаболизма углеводов в тканях. После всасывания из желудочно-кишечного тракта моносахариды поступают через систему портальной вены в печень. В гепатоцитах происходит превращение галактозы и фруктозы в глюкозу. Таким образом, глюкоза является основным моносахаридом, который поступает в общий кровоток после прохождения углеводов через печень.
Содержание глюкозы в крови здорового человека составляет 3,33 – 5,55 ммоль/л. Глюкоза поглощается из крови клетками всех тканей и органов.
10.5.4. Известны врождённые дефекты ферментов обмена лактозы. Врождённый дефект фермента лактазы приводит к развитию непереносимости лактозы. Употребление в пищу молока сопровождается диспептическими явлениями (рвота, диаррея, метеоризм).
23. Молоко как продукт питания. Основные компоненты женского и коровьего молока. Преимущества грудного вскармливания детей.
(ответа нет)