ЛЕКЦИЯ № 3
Тема: Свойства полимеров (ВМС)
П Л А Н
1. Набухание и растворение ВМС.
2. Вязкость растворов ВМС.
3. Осмотическое давление растворов ВМС.
4. Мембранное равновесие Доннана.
К природным высокомолекулярным соединениям относятся полипрены, полисахариды (целлюлоза, крахмал, пектины), белки (альбумины, глобулины, гемоглобин, ферменты) и нуклеиновые кислоты (нуклеопротеиды).
Все ВМС являются нелетучими веществами, не имеющими определенных температур плавления. Растворимость ВМС зависит от состава и строения. Так, полярные макромолекулы, как белки, могут растворяться в воде или в водных растворах солей. Растворы всех ВМС обладают свойствами коллоидов, т.е. скорость диффузии растворенного вещества низка, и макромолекулы не проходят через полупроницаемые мембраны.
Свойства полимеров изменяются при добавлении низкомолекулярных соединений. При этом ослабляются межмолекулярные связи, и повышается пластичность полимера.
Набухание и растворение ВМС
Набухание – процесс проникновения растворителя в полимерное вещество, сопровождаемый увеличением объема и массы образца. Количественно набухание измеряется степенью набухания:
 |
где mo – начальная масса;
no – начальный объем образца полимера;
m – масса; n - объем набухшего образца.
Степень набухания зависит от жесткости полимерных цепей. Жесткие полимеры (с большим числом поперечных связей) характеризуются низкой степенью набухания. Например, эбониты не набухают в бензоле; резины ограниченно набухают в бензине; желатин в горячей воде набухает неограниченно. Степень набухания зависит также от природы растворителя, рН, температуры, от присутствия электролитов.
Термодинамика процесса набухания
Набухание – самопроизвольный процесс и согласно 2-ому закону термодинамики.
DGнаб. < 0 = n (mo - mп)
DG – свободная энергия Гиббса;
n – количество воды, перешедшей в полимер;
mo – химический потенциал чистой воды;
mп – химический потенциал воды в полимере.
Этапы процесса набухания:
I – проникновение растворителя в полимер.
В результате сольватации DНнаб. < 0 (процесс экзотермический),
DS = 0 и DG @ D Ннаб. < 0.
II – начальный этап распределения макромолекул по всему
объему растворителя, при этом: за счет разрыхления
полимерной сетки и частичного освобождения полимера.
DS > 0 DH = 0 A DG = - T DS < 0
III – завершающий этап образования гомогенного
раствора ВМС в результате распределения всех
макромолекул в растворителе. При этом DS > 0,
DH = 0 и DG< 0.
DGраствор = DG1 + DG2 + DG3
Степень набухания ВМС уменьшается с увеличением жесткости кислот – катионов в ряду:
Сs+ > Rb+ > K+ > Na+ > Li2
жесткость воды возрастает, набухание подавляется
CNS- > J- > Br- > NO3- > Cl- > H2O > CH3COO- > F- > SO42-
жесткость основания возрастает, набухание уменьшается
Это – лиотропные ряды
Действие ионов на набухание ВМС связано с дегидратацией молекул ВМС. Жесткие кислоты (Li+) и жесткие основания (F-) гидратируются в большей степени, чем мягкие основания (J-) и мягкие кислоты (CS+), которые легче адсорбируются на поверхности ВМС, и набухание сопровождается растворением белков. В ряду анионов те из них, которые находятся правее воды, подавляют набухание, а которые – левее воды, облегчают набухание. В изоэлектрической точке (И.Э.Т.) ВМС набухает незначительно, но в И.Э.Т. происходит коагуляция.
Вязкость растворов ВМС
Вязкость – мера сопротивления среды движению и характеризуется коэффициентом вязкости - h -.
Коэффициент вязкости - h - является константой пропорциональности, характеризующей сопротивляе-мость системы деформации. Он определяется величиной силы трения (f), действующей между двумя слоями жидкости площадью (А) при градиенте скорости: du / dx или f = h A d u / dx в направлении х, перпендикулярном направлению течения. Таким образом (h) выражает величину силы трения при А=1 и du / dx = 1. Единица абсолютной вязкости – пуаз, ее размерность [дин × cм-2 × сек] или [r × cм-2 × сек-1].
Абсолютная вязкость – есть сила, действующая на единицу площади 1 cм2 и заставляющая соседние слои скользить друг относительно друга при скорости 1 см/сек.
Абсолютная вязкость воды при 20 оС равна 0,010 пуаз или 1,0 сантипуаз. Величина, обратная абсолютной вязкости 1 / h есть текучесть.
Например: эфир обладает высокой текучестью, низкой вязкостью. Глицерин – низкой текучестью, высокой вязкостью.
 Если обозначить коэффициент вязкости растворителя через hо, а коэффициент вязкости раствора ВМС – через hр-р, то отношение этих величин:
Если обозначить коэффициент вязкости растворителя через hо, а коэффициент вязкости раствора ВМС – через hр-р, то отношение этих величин:
будет равно отношению времен истечения t/to через капилляр и называется относительной вязкостью, которая пропорциональна абсолютной вязкости:
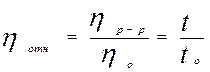 |
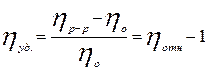 Удельная вязкость характеризует повышение внутреннего сопротивления ВМС:
Удельная вязкость характеризует повышение внутреннего сопротивления ВМС:
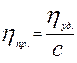 Приведенная вязкость:
Приведенная вязкость:
Приведенная вязкость лучше характеризует свойства растворов ВМС, чем относительная или удельная вязкость.
Приведенная вязкость раствора определенного полимера обычно определяется при различных концентрациях – с -, которая дается в граммах на 100 мл.
Результаты выражаются графически в виде:
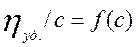 |
и кривая экстраполируется к с=0, и получаем характеристическую вязкость; выражается в г/мл или г/100 мл.
[h] = lim hуд. /с при с ® 0 или
[h] = lim hпр. при с ® 0
 hпр.
hпр.
 |
 [h]
[h]
 |
lim hпр.= [h]
c® 0
Характеристическая вязкость связана с молярной массой полимера уравнением Штаудингера:
[h] = KM
K – коэффициент пропорциональности.
Штаудингер показал, что для разбавленных растворов полимеров с жесткими палочкообразными молекулами
hуд./с = КМ, т.е. отношение удельной вязкости к концентрации раствора полимера (приведенная вязкость) не зависит от концентрации и пропорциональна его молекулярной массе.
К – константа для данного полимергомологического ряда в данном растворителе.
У большинства полимеров приведенная вязкость возрастает с увеличением концентрации в результате взаимодействия макромолекул.
С учетом взаимодействия макромолекул и изменением константы К с длиной молекулы наиболее широко используют уравнение Марка-Куна-Хаувинка для определения молярной массы: [h] = Кма , где
К – коэффициент пропорциональности;
а – показатель степени, который изменяется в пределах:

 1/2 £ а £ 1
1/2 £ а £ 1
для гибких для жестких
полимеров полимеров
Из формулы Штаудингера следует, что вязкое течение полимеров связано с конформацией цепей ВМС и с их жесткостью. Молекулы ВМС при усилении потока жидкости растягиваются, сопротивление течению уменьшается, и вязкость растворов ВМС изменяется.
Коллигативные свойства растворов