ВВЕДЕНИЕ
Целью лабораторных работ является закрепление и систематизация теоретических знаний, полученных при изучении курса, освоение методик постановки экспериментов, приобретение опыта работы с реактивами и оборудованием, навыков обработки и оформления экспериментальных данных.
Требования к оформлению отчета
Отчеты по лабораторным работам выполняют на листах формата А4 (210х297 мм). Оформление отчета должно соответствовать требованиям ГОСТ 2.105-95 «Текстовые документы».
Структура каждого отчета: наименование, цель работы, теоретическая часть, методика проведения экспериментов, результаты экспериментов и расчеты, анализ полученных результатов, выводы.
В теоретической части отчета приводят основные теоретические положения рассматриваемого процесса и его характерные особенности.
Изложение методики эксперимента должно отражать фактические условия и особенности проведения опытов.
При изложении методики указываются наименования применяемых стандартных методов анализа.
Результаты опытов сводят в таблицы, приводят общую формулу расчета и один пример расчета. Все результаты должны иметь размерность системы единиц СИ. По табличным данным строят графические зависимости.
Анализ полученных результатов включает объяснение тех явлений, которые наблюдались при проведении опытов (цвет растворов, осадков, покрытий, изменение окраски, газовыделение, осадкообразование, повышение или понижение температуры и т. п.); оценку влияния тех или иных факторов на характер изменения и величину основных показателей процесса; оценку соответствия протекающих химических реакций теоретическим (указать на подтверждающие признаки).
В выводах отмечают основные достигнутые результаты, выявленные закономерности.
ЛАБОРАТОРНАЯ РАБОТА №1
Сернокислотное выщелачивание окисленной медной руды
Цель работы
Ознакомиться с особенностями сернокислотного выщелачивания меди из окисленной медной руды, изучить влияние некоторых факторов на извлечение меди в продуктивный раствор.
Необходимые материалы, реактивы и оборудование
1.Окисленная медная руда (минеральный состав руды задается преподавателем);
2. Концентрированная серная кислота (96 %-ный водный раствор с плотностью 1,84 г/см3);
3. Вода дистиллированная;
4. Реакционный стакан емкостью 0,25 л;
5. Мерный цилиндр емкостью 0,25 л;
6. Три колбы емкостью 0,2 л;
7. Воронка для фильтрования диаметром 40-50 мм;
8. Бумажные фильтры;
9. Пробоотборник емкостью 0,01 л;
10. Пипетка на 5 мл;
11. Резиновая груша;
12. Мешалка механическая;
13. Весы электронные.
Проведение работы
На электронных весах взвесить 50 г исходной руды.
Используя правило «креста», рассчитать требуемое количество концентрированной серной кислоты и дистиллированной воды для приготовления 100 г 5 % - ного раствора.
Приготовление раствора производить только под вытяжкой. При этом следует помнить, кислоту льют в воду, а не наоборот.
Навеску исходной руды поместить в реакционный стакан, залить приготовленным раствором для выщелачивания.
Пульпу перемешивать с помощью механической мешалки в течение 30 минут.
Через каждые 10 минут от начала опыта с помощью пробоотборника (не останавливая мешалки) отобрать пробу пульпы (10 см3) и отфильтровать её через сухой бумажный фильтр, в сухую колбу. Полученные фильтраты пронумеровать (номер бригады, номер пробы) и подвергнуть анализу на определение концентрации меди в продуктивном растворе.
После окончания опыта оставшееся содержимое реакционного стакана отфильтровать аналогично п. 6, подписать и сохранить для проведения следующей лабораторной работы.
После окончания работы промыть и протереть мешалку, привести в порядок рабочее место. Использованные бумажные фильтры с кеком выбросить в корзину для мусора.
По результатам анализов рассчитать извлечение меди в продуктивный раствор по формуле:
εi = CCui *(Vисх.-Vi*ni)/m*β, %,
где CCui – концентрация меди в i-той пробе продуктивного раствора, г/дм3 (определяется по методике фотометрического определения меди на основе аммиачного комплекса, приведенной ниже);
Vисх.- объем исходного раствора, дм3;
Vi - объем продуктивного раствора в i-той пробе, дм3;
ni – порядковый номер i-той пробы;
m – масса навески, г;
β – массовая доля меди в навеске, доли ед.
Объем исходного раствора Vисх. рассчитывают по правилу «креста» с учетом плотности 5 % - ного раствора серной кислоты (1,032 кг/ дм3). Объем продуктивного раствора в i-той пробе рассчитывают из соотношения
Vисх. п./ Vп. i = Vисх./ Vi.,
где Vисх.п. - объем исходной пульпы, дм3;
V п. i - объем пульпы i-той пробы, дм3.
Отсюда, Vi = Vисх.* 0,01/ Vисх. п., дм3.
Объем исходной пульпы рассчитывается по формуле:
Vисх.п. = m (R + 1/ρ),
где R – массовое отношение жидкого к твердому;
ρ – плотность руды, кг/дм3 (задается преподавателем).
По полученным данным строят графики зависимостей концентрации меди в продуктивном растворе и извлечения меди в продуктивный раствор от продолжительности выщелачивания CCui = f (t) и ε = f (t) и делают соответствующие выводы.
В теоретической части отчета необходимо:
1. Привести основные факторы, влияющие на скорость агитационного выщелачивания;
2. Привести основные показатели процесса выщелачивания;
3. Привести факторы, влияющие на выбор реагента;
4. Дать запись реакций, протекающие при выщелачивании окисленной медной руды с учетом заданного минерального состава.
Методика фотометрического определения меди на основе аммиачного комплекса
Теоретическая часть
Соли меди образуют с водой комплексные катионы состава [Cu(H2O)]2+, окрашенные в светло-голубой цвет, а в присутствии аммиака медно-аммиачные комплексные катионы состава [Cu(NH3)4]2+, окрашенные в темно-синий цвет. Существует также ряд промежуточных катионов, образование которых зависит от концентрации солей и аммиака в растворе. Все эти промежуточные катионы имеют различные коэффициенты поглощения света. Поэтому, работая по этой методике, воспроизводимые и точные результаты можно получить только при соблюдении одинаковых условий подготовки испытуемых растворов. Данный метод можно использовать для определения катионов меди в растворе в присутствии ионов железа, цинка и др.
Необходимые материалы, реактивы и оборудование:
- фотоколориметр КФК-2;
- 30 %-ный водный раствор перекиси водорода H2O2;
- 25 %-ный водный раствор аммиака (плотность 0,94 г/см3);
- дистиллированная вода;
- колба емкостью 0,1 л;
- пипетка на 5 мл;
- резиновая груша;
- воронка для фильтрования диаметром 40-50 мм;
- бумажные фильтры;
- три пикнометра емкостью 25 мл;
- две кюветы 50/120.
Методика проведения анализа
1. В колбу с 10 мл пробы анализируемого раствора добавляют 1 мл перекиси водорода для окисления ионов железа Fe2+ до Fe3+, туда же добавляют 5 мл раствора аммиака.
2. Полученную смесь фильтруют. Из фильтрата отбирают аликвотную часть 2,5 мл (в случае получения сильной окраски), переводят в пикнометр объемом 25 мл, доводят до отметки дистиллированной водой и перемешивают.
3. На фотоколориметре измеряют оптическую плотность раствора при длине волны 675 нм при применении красного светофильтра. Ручку «чувствительность» устанавливают в положение «1», отмеченное на панели красным цветом. Раствором сравнения служит дистиллированная вода. Для того чтобы относительная ошибка определения концентрации раствора была минимальной, работу производят вблизи оптической плотности 0,1-1 (коэффициент пропускания 40-60 %). Кювета 50/120.
4. По графику (см. рисунок 1) определяют значения концентрации меди в растворе. Далее рассчитывают истинное значение концентрации меди, учитывая разбавление, по формуле:
С = СCu по графику*P*К/1000, г/л,
где СCu по графику – концентрация меди, определенная по графику, мг/л;
Р – разбавление раствора;
К – коэффициент, учитывающий сорбцию ионов меди ионами железа (по данным практики для этого метода составляет 10 %), К=1,1.
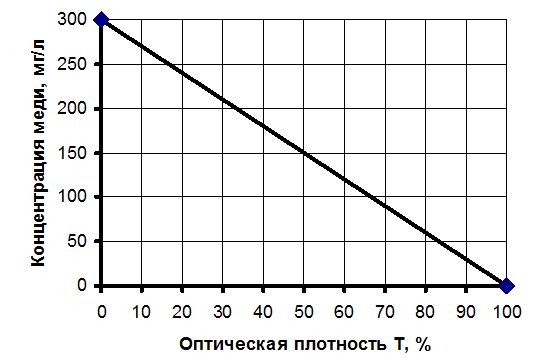 |
Рисунок 1 – Зависимость концентрации меди от оптической плотности раствора
ЛАБОРАТОРНАЯ РАБОТА №2