Общие сведения.
Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются.
Различают три типа гидролизующих солей:
1. Соли, образованные сильной кислотой и слабым основанием,
гидролизуются по катиону.
2. Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону с образованием слабой кислоты или иона кислой соли.
3. Соли, образованные слабой кислотой и слабым основанием, гидролизуются по обоим составляющим их ионам с образованием сразу двух слабых электролитов.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
1. Чем слабее кислота или основание, образующиеся в результате гидролизе, тем выше глубина протекания процесса.
2. С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
3. Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
4. Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
5. При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Ход работы:
Опыт 1.
Гидролиз солей.
В отдельные пробирки налить по 3-4 капли растворов хлорида железа (III), сульфата цинка, сульфата алюминия, карбоната натрия и сульфида натрия. Добавить
по 1-2 капли лакмуса и записать в таблицу окраску каждого из растворов этих солей. Вылить содержимое пробирок, промыть их дистиллированной водой и вновь налить указанные выше растворы. Добавить по 1-2 капли фенолфталеина и записать окраску растворов.
| Номер опыта | Формула соли | Окраска лакмуса | Окраска фенол- фталеина | Характер раствора |
| № 1 № 2 № 3 № 4 № 5 | 

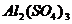


| красный фиолетовый фиолетовый синий синий | бесцветная бесцветная бесцветная малиновая малиновая | 


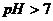
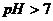
|
1. 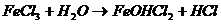
 ( характер раствора -кислый ).
( характер раствора -кислый ).
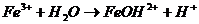
2. 
 ( характер раствора - кислый ).
( характер раствора - кислый ).

3. 
 ( характер раствора - кислый ).
( характер раствора - кислый ).

4. 
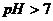 ( характер раствора - щелочной ).
( характер раствора - щелочной ).

5. 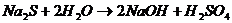
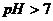 ( характер раствора - щелочной ).
( характер раствора - щелочной ).
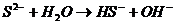
Опыт 4.
Взаимное усиление гидролиза при взаимодействии растворов двух солей.
В одну пробирку налить 3-5 капель раствора хлорида железа (Ш), во вторую – столько же раствора сульфата алюминия, в третью - столько же раствора сульфата хрома (Ш). В первые две пробирки добавить 3-5 капель раствора карбоната натрия, в третью – столько же раствора сульфида натрия.
1. 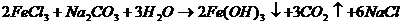
I. 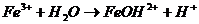

II. 
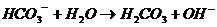
III. 
Выпал осадок коричневого цвета и выделился газ.
2. 
I. 

II. 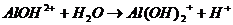

III. 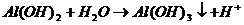
Выпал осадок белого цвета и выделился газ.
3. 
I. 

II. 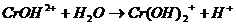

III. 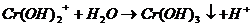
Выпал осадок синего цвета и выделился газ.
Вывод: в результате реакции взаимного усиления гидролиза образуется слабое основание и слабая кислота.
Вывод: в ходе лабораторной работы я ознакомился с процессом гидролиза солей и его следствиями, научился составлять уравнения гидролиза. Также исследовал реакции взаимного усиления гидролиза, в результате которой образуется слабое основание и слабая кислота.