Концентрационные цепи бывают двух родов. Концентрационные цепи первого рода содержат два металла или сплава, различающихся по концентрации активной массы или по составу сплава и погруженных в один и тот же раствор. Примером газовой концентрационной цепи первого рода может служить элемент, составленный из двух газовых, например хлорных, электродов с различными давлениями газа в приэлектродных пространствах и общим раствором электролита – соляной кислотой НСl:
(-)Cl2(p1)Pt|HCl|Cl2 (p2),Pt(+); p2>p1 (3.19)
Концентрационные цепи второго рода состоят из двух электродов одного металла, например Аg, покрытого своей нерастворимой солью АgС1, и погруженных в растворы HCl с различной активностью ионов хлора а1 и а2.
(-)Ag,AgCl|HCl||HCl|AgCl,Ag(+) (3.20)
В случае разбавленных растворов вместо величин активностей а1 и а2 можно пользоваться величинами концентраций растворов С1 и С2.
Скачок потенциала на границе раздела фаз в данном случае возникает за счет того, что на электроде, погруженном в менее активный (с меньшей концентрацией) раствор, протекает процесс окисления серебра по схеме:
Аgo + Cl- → АgCl + е.
На электроде, погруженном в более активный раствор (с большей концентрацией раствора НСl), протекает процесс восстановления хлорида серебра:
АgCl + е → Аgo + Cl-.
При работе указанного элемента оба электрода термодинамически не изменяются, а ЭДС концентрационного элемента возникает за счет диффузии ионов из мест с большей их концентрацией в более разбавленный раствор, т.е. за счет выравнивания концентраций между двумя растворами. Поэтому такие гальванические элементы называются концентрационными элементами, или цепями с переносом.
Без учета диффузионного потенциала, возникающего на границе раздела двух растворов за счет различной скорости движения ионов, электродные потенциалы анода Ea и катода Ек будут равны соответственно:
 ; (3.21)
; (3.21)
 . (3.22)
. (3.22)
Так как Ек° = Еа°, а n = 1, то ЭДС (∆Е) такого концентрационного элемента
 . (3.23)
. (3.23)
Для того чтобы рассчитать диффузионный потенциал, вначале следует рассмотреть процесс его возникновения. Переход НСl из раствора с более высокой активностью в менее активный осуществляется за счет диффузии ионов Н+ и С1-, скорость которой определяется их подвижностью, пропорциональной скорости движения ионов. Если градиент приложенного напряжения внешнего поля равен 1 В/см, то в данном случае скорость движения ионов называется абсолютной скоростью.
Подвижность иона (λ+ и λ-) представляет собой произведение абсолютной скорости иона (V+ и V-) на число Фарадея
λ+ = V+∙ F; λ- = V-∙ F. (3.24)
Доля количества электричества, которую переносит данный ион, называется числом переноса иона:
катиона:
 ;
;
аниона: (3.25)
 .
.
Для бесконечно разбавленного раствора:
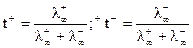 .
.
В рассматриваемом примере

 . (3.26)
. (3.26)
Сумма tH+ и tCl- равна единице. Так как подвижность иона Н+ больше, чем иона С1-, то менее концентрированный раствор будет заряжаться согласно знаку более подвижного иона Н+, т.е. будет содержать больше положительных ионов, а более концентрированный раствор − больше отрицательных ионов. Вследствие этого и возникает диффузионный скачок потенциала на границе раздела фаз, одинаковых по природе, но разных по концентрации растворов. В общем случае ЭДС концентрационного элемента
 , (3.27)
, (3.27)
где  . (3.28)
. (3.28)