ОТ КОРРОЗИИ
Коррозия металлов − самопроизвольный процесс разрушения (окисления) металла за счет его взаимодействия с окислителем окружающей среды.
Основные механизмы протекания коррозионных процессов − электрохимический и химический.
Критерием протекания коррозии по одному из перечисленных выше механизмов является состав (природа) среды.
Химической коррозии подвергаются металлы, находящиеся в средах, не проводящих электрический ток, например в сухих газах в присутствии окислителей О2, СО2, Сl2, J2, H2S и других (газовая коррозия), в неводных растворах (раствор йода в бензоле, сернистая нефть) или в агрессивных средах, не содержащих воды (концентрированные растворы кислот, щелочей и т.д.). Газовой коррозии подвержены сопла ракет, двигатели внутреннего сгорания и т.п. В этом случае разрушение металла происходит за счет его непосредственного взаимодействия с окислителем.
Более распространенной является электрохимическая коррозия металлов, так как в основном изделия из металлов и сплавов эксплуатируются в атмосферных условиях, в которых присутствует вода в большем или меньшем количестве в зависимости от природы среды: почва, влажный воздух, полное погружение изделия в электролит и т.п. Таким образом, электрохимической коррозии (критерий – токопроводящая среда) подвержены те металлические изделия, которые находятся в растворах электролитов или во влажном воздухе. Это электрохимический процесс, так как на поверхности металла имеются участки с различным значением электродного потенциала и образуются так называемые короткозамкнутые микрогальванопары и вследствие этого электрический ток.
Электрохимическая коррозия – многостадийный процесс, основными стадиями которого являются: окисление металла на анодных участках корродирующего металла и восстановление окислителя из окружающей среды − на катодных.
Рассмотрим в качестве примера коррозию железа в растворе НСl.
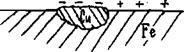
Рис. 5.1. Коррозия железа в кислой среде
Так как абсолютно чистый металл получить невозможно, то практически любая железная пластина, как правило, содержит включение других металлов, например Сu, Sn, Pb и др. Железо является более электроотрицательным металлом, чем указанные примеси, так как его стандартный электродный потенциал  , в то время как
, в то время как  .
.
Поэтому железо будет анодом любой из возможных микрогальванопар и происходит его разрушение по схеме:
(-) А(Fe): Feo −2e → Fe2+. (5.1)
Отдаваемые железом электроны внутри металла перемещаются к участку с более высоким значением потенциала (в данном случае к медному включению), который служит катодом. В кислой среде на нем происходит процесс восстановления водорода:
(+) K (Cu): 2H+ + 2e → H2. (5.2)
В связи с тем, что электрохимическая коррозия протекает в растворах электролитов, процесс, имеющий место на катоде, определяется кислотностью (рН) среды. В кислых средах, как показано выше, происходит образование водорода при восстановлении свободных ионов Н+, в нейтральных и щелочных средах без доступа кислорода протекает процесс выделения водорода из воды:
2Н2О + 2е → Н2 + 2ОН- Е° = -0,828В. (5.3)
В нейтральных или щелочных средах с доступом кислорода происходит восстановление последнего по схеме
O2+ 2Н2О +4e → 4ОН- Е° = 0,401В. (5.4)
Таким образом, если рассмотреть с точки зрения коррозионных процессов микрогальванопару, представленную на рис. 5.1, т.е. два контактирующих металла железо−медь, то в зависимости от состава среды катодные процессы (схемы 5.5) будут различными, а анодный во всех случаях один и тот же:
● кислая среда (-) А(Fe): Feo − 2e → Fe2+
(+) К(Cu): 2H+ + 2e → H2o;
● токопроводящая среда в отсутствии кислорода
(-) А(Fe): Feo − 2e → Fe2+
(+) К(Cu): 2Н2О + 2е → Н2 + 2ОН-; (5.5)
● токопроводящая среда в присутствии кислорода
(-) А(Fe): Feo − 2e → Fe2+
(+) К(Cu): O2 + 2Н2О +4e → 4ОН- .
В дальнейшем в случае присутствия в коррозионной среде ионов ОН- протекают «вторичные» коррозионные процессы – образование различных по составу гидроксидов, составляющих основу ржавщины:
Fe2+ + 2ОН- → Fe(ОН)2 (5.6)
4Fe(ОН)2 + O2 + 2Н2О →4 FeООН ∙Н2О. (5.7)