Спектральные методы.
а ) При помощи спектроскопа (прибор для визуальной спектроскопической диагностики). Исследуемую кровь разводят водой до светло-розовой окраски и смотрят ее спектр. При этом спектр крови, содержащей дезоксиHb имеет одну широкую полосу при 550 нм. Спектр оксигемоглабина содержит две полосы при 557-589 нм и при 536-556 нм.
Карбоксигемоглобин содержит 2 полосы при 564-579 нм и при 523-536 нм. Берут исследуемую кровь и смотрят в спектроскоп. Наблюдается 3 полосы поглощения (COHb, OHb, Hb). Далее к крови добавляют дитионит натрия. OHb восстанавливается до Hb, а COHb не восстанавливается. Если остается 3 полосы поглощения, то было отравления, а если остается только одна, то не было. Метод удобен, если содержание COHb в крови составляет 10-30%.
Б) Основной метод – СФМ.
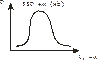


Берут исследуемую кровь и смотрят – 2 пика. Добавляют дитионит Na. Если сохраняются 2 пика, то отравление было (COHb не восстанавливается), а если они сливаются в один, то отравления угарным газом не было (OHb восстанавливается).
Количественное определение:
1. Берется донорская кровь без CO, разводится раствором NH4OH, отфильтровывается и добавляется восстановитель Na2S2O4. Наблюдаем спектр гемоглобина (максимум при 550 нм). Через кровь с подозрением на CO пропускаем CO (для того, чтобы его получить, к формальдегиду прибавляем H2SO4) чтобы полностью перевести OHb, Hb, MetHb в COHb и затем смотрим спектр (2 максимума, характерные для COHb). Оба спектра накладываем друг на друга и получаем три изобестические точки в местах пересечения при 550, 560 и 580 нм.

В этих точках пересечения оптические плотности COHb и Hb будут одинаковыми. На основании экспериментальных данных, наибольшая разница оптической плотности COHb и Hb наблюдается при 538 нм. Рассчитываем содержание COHb по формуле:
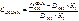
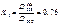

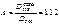
В исследуемую кровь, взятую на анализ, добавляют дитионит натрия и снимают спектр при 538 и 560 нм. Коэффициенты 0,76 и 0,38 для каждого прибора индивидуальны.
2. Газохроматографическое определение. В пенициллиновый флакон помещают 2,5 мл крови + 0,5 мл к.H2SO4 и 1,0 феррацианида калия. Закрывают резиновой пробкой, фиксируют (под обкатку), встряхивают 30 секунд, отбирают газовую фазу и вводят в хроматограф. На хроматограмме 2 пика – воздуха и CO. Определяют по времени удерживания.
 Исследование относительно больших осадков сульфата свинца
Реакция с иодидом калия. выпадает желтый осадок PbI 2
Реакция с сероводородной водой. Появление черного осадка сульфида свинца
Реакция с серной кислотой. Появление белого осадка.
Исследование малых осадков сульфата свинца
1)Выделение ионов свинца из минерализата. прибавляют хлороформный раствор дитизона. При этом образуется Pb(HDz) 2, имеет оранжево-красную окраску: (основная)
Исследование относительно больших осадков сульфата свинца
Реакция с иодидом калия. выпадает желтый осадок PbI 2
Реакция с сероводородной водой. Появление черного осадка сульфида свинца
Реакция с серной кислотой. Появление белого осадка.
Исследование малых осадков сульфата свинца
1)Выделение ионов свинца из минерализата. прибавляют хлороформный раствор дитизона. При этом образуется Pb(HDz) 2, имеет оранжево-красную окраску: (основная)
 (тион-тиольная таутомерия)
(тион-тиольная таутомерия)
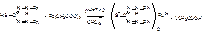 Хлороформный слой окрашивается в пурпурно-красный цвет. Его отделяют и добавляют раствор HNO3 (реэкстракция).
Хлороформный слой окрашивается в пурпурно-красный цвет. Его отделяют и добавляют раствор HNO3 (реэкстракция).
 Хлороформный слой отбрасывают и с реэкстрактом проводят реакции:
2. С насыщенным раствором Na2S à черный осадок.
Pb(NO3)2 + Na2S à PbS↓ + 2NaNO3
3. Образование сульфата (белый осадок).
Pb(NO3)2 +H2SO4 à PbSO4↓ + 2HNO3
4. С раствором KI. Желтый осадок (золотой дождь).
Pb(NO3)2 + KI à PbI2↓ + 2KNO3
5. С K2Cr2O7. Желто-оранжевый осадок.
Pb(NO3)2 + K2Cr2O7 + H2O à 2PbCrO4↓+ 2KNO2 + 2H2O
Микрокристаллические реакции:
Реакция с хлоридом цезия и иодидом калия. образуются желто-зеленые игольчатые кристаллы, собранные в виде сфероидов:
Хлороформный слой отбрасывают и с реэкстрактом проводят реакции:
2. С насыщенным раствором Na2S à черный осадок.
Pb(NO3)2 + Na2S à PbS↓ + 2NaNO3
3. Образование сульфата (белый осадок).
Pb(NO3)2 +H2SO4 à PbSO4↓ + 2HNO3
4. С раствором KI. Желтый осадок (золотой дождь).
Pb(NO3)2 + KI à PbI2↓ + 2KNO3
5. С K2Cr2O7. Желто-оранжевый осадок.
Pb(NO3)2 + K2Cr2O7 + H2O à 2PbCrO4↓+ 2KNO2 + 2H2O
Микрокристаллические реакции:
Реакция с хлоридом цезия и иодидом калия. образуются желто-зеленые игольчатые кристаллы, собранные в виде сфероидов:
 Реакция с ацетатом меди и нитритом калия.Образование черных или коричневых кристалликов, имеющих форму куба
Реакция с ацетатом меди и нитритом калия.Образование черных или коричневых кристалликов, имеющих форму куба
 Количественное определение:
а) бихроматно-йодометрическим по избытку бихромата.
2РЬ(ОСОСН3)2 + К2Сг207 + НОН = 2РЬСЮ4 + 2СН3СООК + 2СИ3СООН;
К2Сг207 + 6KI + 7H2S04 = 3I2 + Cr2(S04)3 + 4K2S04 + 7Н20,
I2 + 2Na2S203 = 2NaI + Na2S40s
б) экстракционно-фотометрически по дитизонату свинца.
Pb(0C0CH3)2 + 2H2Dz (при рН 7-10) = Pb(HDz)2 + 2СН3С00Н.
в) комплексонометрическим
к исследуемому раствору, содержащему определенный катион, прибавляют при строго определенном значении рН небольшое количество соответствующего индикатора — образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с катионом. При титровании трилонюм Б (комплексов III) —динатриевой солью зтилендиаминтетрауксусной кислоты— комплекс катиона с индикатором разрушается, так как трилон Б образует более прочный комплекс с определяемым катионом. В эквивалентной точке выделяется свободный индикатор, окрашивая раствор в цвет, присущий индикатору при данном значении рН среды.
Большинство катионов определяется в щелочной среде, для чего в титруемый раствор вводят аммиачный буфер (смесь аммиака и хлорида аммония).
Г)йодометрия
Количественное определение:
а) бихроматно-йодометрическим по избытку бихромата.
2РЬ(ОСОСН3)2 + К2Сг207 + НОН = 2РЬСЮ4 + 2СН3СООК + 2СИ3СООН;
К2Сг207 + 6KI + 7H2S04 = 3I2 + Cr2(S04)3 + 4K2S04 + 7Н20,
I2 + 2Na2S203 = 2NaI + Na2S40s
б) экстракционно-фотометрически по дитизонату свинца.
Pb(0C0CH3)2 + 2H2Dz (при рН 7-10) = Pb(HDz)2 + 2СН3С00Н.
в) комплексонометрическим
к исследуемому раствору, содержащему определенный катион, прибавляют при строго определенном значении рН небольшое количество соответствующего индикатора — образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с катионом. При титровании трилонюм Б (комплексов III) —динатриевой солью зтилендиаминтетрауксусной кислоты— комплекс катиона с индикатором разрушается, так как трилон Б образует более прочный комплекс с определяемым катионом. В эквивалентной точке выделяется свободный индикатор, окрашивая раствор в цвет, присущий индикатору при данном значении рН среды.
Большинство катионов определяется в щелочной среде, для чего в титруемый раствор вводят аммиачный буфер (смесь аммиака и хлорида аммония).
Г)йодометрия
 Оксиды азота окисляются кислородом воздуха до оксида азота (IV), при взаимодействии которого с водой образуются азотная и азотистая кислоты, разлагающиеся мочевиной, как указано выше.
Методика деструкции органов трупов. 20 г измельченных органов трупов вносят в коническую колбу вместимостью 200 мл, в которую прибавляют 5 мл воды, 1 мл этилового спирта и 10 мл концентрированной азотной кислоты. Затем в колбу малыми порциями прибавляют 20 мл концентрированной серной кислоты с такой скоростью, чтобы оксиды азота не выделялись из колбы. После окончания прибавления концентрированной серной кислоты колбу оставляют на 5—10 мин при комнатной температуре (до прекращения выделения оксидов азота). Затем колбу устанавливают на кипящую водяную баню и нагревают в течение 10—20 мин. Если после нагревания колбы на кипящей водяной бане останутся неразрушенными кусочки биологического материала, то их осторожно растирают стеклянной палочкой о стенки колбы. При бурном протекании реакции с выделением оксидов азота в колбу прибавляют 30—50 мл горячей воды. Полученный горячий деструктат смешивают с двойным объемом кипящей воды и, не охлаждая жидкость, фильтруют ее через двойной увлажненный фильтр. Фильтр, через который фильтровали деструктат, и остатки жира на нем 2—3 раза промывают горячей водой. Промывные воды присоединяют к профильтрованному деструктату. Полученную при этом жидкость собирают в колбу, содержащую 20 мл насыщенного раствора мочевины, предназначенной для денитрации деструктата. Затем деструктат охлаждают, доводят водой до определенного объема и исследуют его на наличие ртути
Деструкция органических веществ в моче
(проба Рейшина). К моче добавляют медные спиральки, HCl, и нагревают на водяной бане. Если было отравление, спиральки покрываются налетом, их вынимают, промывают последовательно водой, спиртом, эфиром и помещают в тугоплавкую пробирку, добавляют кристаллы I2, нагревают в пламене горелки; выносят из пламени, охлаждают смоченным тампоном. Под микроск видны крист характерной формы.
Деструкция органических веществ в крови. Для этой цели применяют методику, которая используется для деструкции органов трупов (см. выше), с той лишь разницей, что к пробе крови не прибавляют воду. На исследование берут по 50—100 мл крови.
Обнаружение ртути в деструктате
Реакция с дитизоном.
Оксиды азота окисляются кислородом воздуха до оксида азота (IV), при взаимодействии которого с водой образуются азотная и азотистая кислоты, разлагающиеся мочевиной, как указано выше.
Методика деструкции органов трупов. 20 г измельченных органов трупов вносят в коническую колбу вместимостью 200 мл, в которую прибавляют 5 мл воды, 1 мл этилового спирта и 10 мл концентрированной азотной кислоты. Затем в колбу малыми порциями прибавляют 20 мл концентрированной серной кислоты с такой скоростью, чтобы оксиды азота не выделялись из колбы. После окончания прибавления концентрированной серной кислоты колбу оставляют на 5—10 мин при комнатной температуре (до прекращения выделения оксидов азота). Затем колбу устанавливают на кипящую водяную баню и нагревают в течение 10—20 мин. Если после нагревания колбы на кипящей водяной бане останутся неразрушенными кусочки биологического материала, то их осторожно растирают стеклянной палочкой о стенки колбы. При бурном протекании реакции с выделением оксидов азота в колбу прибавляют 30—50 мл горячей воды. Полученный горячий деструктат смешивают с двойным объемом кипящей воды и, не охлаждая жидкость, фильтруют ее через двойной увлажненный фильтр. Фильтр, через который фильтровали деструктат, и остатки жира на нем 2—3 раза промывают горячей водой. Промывные воды присоединяют к профильтрованному деструктату. Полученную при этом жидкость собирают в колбу, содержащую 20 мл насыщенного раствора мочевины, предназначенной для денитрации деструктата. Затем деструктат охлаждают, доводят водой до определенного объема и исследуют его на наличие ртути
Деструкция органических веществ в моче
(проба Рейшина). К моче добавляют медные спиральки, HCl, и нагревают на водяной бане. Если было отравление, спиральки покрываются налетом, их вынимают, промывают последовательно водой, спиртом, эфиром и помещают в тугоплавкую пробирку, добавляют кристаллы I2, нагревают в пламене горелки; выносят из пламени, охлаждают смоченным тампоном. Под микроск видны крист характерной формы.
Деструкция органических веществ в крови. Для этой цели применяют методику, которая используется для деструкции органов трупов (см. выше), с той лишь разницей, что к пробе крови не прибавляют воду. На исследование берут по 50—100 мл крови.
Обнаружение ртути в деструктате
Реакция с дитизоном.
 В кислой среде дитизонат ртути имеет оранжево-желтую окраску, а в щелочной или слабокислой — пурпурно-красную.
Реакция со взвесью иодида меди (I)образуется красный осадок Cu 2 [HgI 4 ]:
В кислой среде дитизонат ртути имеет оранжево-желтую окраску, а в щелочной или слабокислой — пурпурно-красную.
Реакция со взвесью иодида меди (I)образуется красный осадок Cu 2 [HgI 4 ]:
 K2HgI4 + 2CuSO4 + 2KI + Na2SO3 + 2NaHCO3 à Cu2HgI4↓ + 2CO2 + 2K2SO4 + Na2SO4 + H2O + 2NaI
2CuSO4 + 4KI à 2CuI2 + 2K2SO4
2CuI2 à I2 + 2CuI
2CuI + K2HgI4 à Cu2HgI4 + 2KI
I2 + H2O + Na2SO3 à 2HI + Na2SO4
2HI + 2NaHCO3 à 2NaI + 2CO2 + 2H2O
Сульфит натрия используется в реакции, чтобы убрать I2, который будет мешать окраске. Выделяющийся HI будет разлагать медный комплекс, поэтому добавляют NaHCO3.
КО: 1)ФЭК(по р-ции Рубцова,комплекс с дитизоном)
2)СФМ(по видимой области с дитизоном)
3)Визуальная колориметрия по тетрайодмеркурату Н2НgY4
K2HgI4 + 2CuSO4 + 2KI + Na2SO3 + 2NaHCO3 à Cu2HgI4↓ + 2CO2 + 2K2SO4 + Na2SO4 + H2O + 2NaI
2CuSO4 + 4KI à 2CuI2 + 2K2SO4
2CuI2 à I2 + 2CuI
2CuI + K2HgI4 à Cu2HgI4 + 2KI
I2 + H2O + Na2SO3 à 2HI + Na2SO4
2HI + 2NaHCO3 à 2NaI + 2CO2 + 2H2O
Сульфит натрия используется в реакции, чтобы убрать I2, который будет мешать окраске. Выделяющийся HI будет разлагать медный комплекс, поэтому добавляют NaHCO3.
КО: 1)ФЭК(по р-ции Рубцова,комплекс с дитизоном)
2)СФМ(по видимой области с дитизоном)
3)Визуальная колориметрия по тетрайодмеркурату Н2НgY4
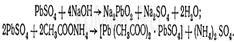 4.Реакция с родизонатом натрия основана на том, что родизонат натрия с солями бария образует родизонат бария, имеющий красную окраску. От прибавления серной кислоты или сульфатов к родизонату бария он разлагается. При этом образуется осадок сульфата бария и исчезает красная окраска родизоната:
4.Реакция с родизонатом натрия основана на том, что родизонат натрия с солями бария образует родизонат бария, имеющий красную окраску. От прибавления серной кислоты или сульфатов к родизонату бария он разлагается. При этом образуется осадок сульфата бария и исчезает красная окраска родизоната:

 SCN-
. Изолирование:
а) Макродистилляция с селективным уносчиком (N2), синильную кислоту собирают в щелочной раствор.
б) Микродистилляция (из крови и мочи).
в) Паро-воздушная дистилляция (метод Герасимова).
голубое или зеленоватое окрашивание):-лазурь
При небольших количествах, окраска проявляется через 2 суток.Реакция образования берлинской лазури
SCN-
. Изолирование:
а) Макродистилляция с селективным уносчиком (N2), синильную кислоту собирают в щелочной раствор.
б) Микродистилляция (из крови и мочи).
в) Паро-воздушная дистилляция (метод Герасимова).
голубое или зеленоватое окрашивание):-лазурь
При небольших количествах, окраска проявляется через 2 суток.Реакция образования берлинской лазури
 Реакция образования роданида железа
Реакция образования роданида железа
 Реакция образования бензидиновой сини.
Реакция образования бензидиновой сини.

 Реакция с пикриновой кислотой
Реакция с пикриновой кислотой
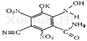 С пиридинбензидиновым раствором.
С пиридинбензидиновым раствором.
 Для усиления окрашивания:
Для усиления окрашивания:
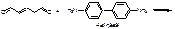
 . Количественное определение.
а) Материал свежий – аргентометрия по Фольгарду. Индикатор FeNH4(SO4)2.
б) Начались гнилостные процессы – гравиметрия.
HCN, H2S + 3AgNO3 à AgCN↓, Ag2S↓ + 3HNO3
Осадок отфильтровывают, отделяют и промывают раствором NH4OH
Ag(NH3)CN переходит в раствор, а Ag2S остается на фильтре. К полученному раствору добавляют HNO3, AgCN снова выпадает в осадок, его промывают, высушивают, взвешивают.
в) С пиридинбензидиновым раствором (вторая реакция идентификации).
. Количественное определение.
а) Материал свежий – аргентометрия по Фольгарду. Индикатор FeNH4(SO4)2.
б) Начались гнилостные процессы – гравиметрия.
HCN, H2S + 3AgNO3 à AgCN↓, Ag2S↓ + 3HNO3
Осадок отфильтровывают, отделяют и промывают раствором NH4OH
Ag(NH3)CN переходит в раствор, а Ag2S остается на фильтре. К полученному раствору добавляют HNO3, AgCN снова выпадает в осадок, его промывают, высушивают, взвешивают.
в) С пиридинбензидиновым раствором (вторая реакция идентификации).
 Толуоловый слой окрашивается в синий цвет.
Такой же эффект дает таллий, поэтому чтобы их различить, проводят реакцию с тиосульфатом Na
Реакция с малахитовым зеленым. основана на том, что малахитовый зеленый, являющийся основным красителем, с ацидокомплексом сурьмы [SbCl 6 ] - образует ионный ассоциат, который экстрагируется ксилолом или толуолом, окрашивая эти растворители в синий или голубой цвет.
Под влиянием нитрита натрия Sb (III) переходит в Sb(V):
Толуоловый слой окрашивается в синий цвет.
Такой же эффект дает таллий, поэтому чтобы их различить, проводят реакцию с тиосульфатом Na
Реакция с малахитовым зеленым. основана на том, что малахитовый зеленый, являющийся основным красителем, с ацидокомплексом сурьмы [SbCl 6 ] - образует ионный ассоциат, который экстрагируется ксилолом или толуолом, окрашивая эти растворители в синий или голубой цвет.
Под влиянием нитрита натрия Sb (III) переходит в Sb(V):
 Избыток нитрита натрия разлагают мочевиной:
Избыток нитрита натрия разлагают мочевиной:
 При взаимодействии с соляной кислотой образуется ацидокомплекс [SbCl 6 ]:
При взаимодействии с соляной кислотой образуется ацидокомплекс [SbCl 6 ]:
 Ацидокомплекс сурьмы [SbCl 6 ] - с катионом малахитового, зеленого (или бриллиантового зеленого) образует ионный ассоциат (синий или голубой):
Ацидокомплекс сурьмы [SbCl 6 ] - с катионом малахитового, зеленого (или бриллиантового зеленого) образует ионный ассоциат (синий или голубой):
 Реакция с тиосульфатом натрия. выпадает оранжевый осадок Sb 2 S 3:
Реакция с тиосульфатом натрия. выпадает оранжевый осадок Sb 2 S 3:
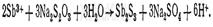 При определенных условиях протекания этой реакции вместо осадка Sb 2 S 3 может образоваться красный осадок серооксида сурьмы (сурьмяной киновари) Sb 2 OS 2:
При определенных условиях протекания этой реакции вместо осадка Sb 2 S 3 может образоваться красный осадок серооксида сурьмы (сурьмяной киновари) Sb 2 OS 2:
 Большой избыток кислоты мешает реакции образования Sb 2 S 3, так как при этом происходит разложение тиосульфата натрия с выделением серы:
Большой избыток кислоты мешает реакции образования Sb 2 S 3, так как при этом происходит разложение тиосульфата натрия с выделением серы:
 Количественное определение 1)сурьмы основано на фотоэлектро-колориметрическом (или визуальном) определении по комплексу гексахлорсурьмиата (SbCl6)~ с малахитовым или бриллиантовым зеленым, экстрагируемому толуолом. Граница определения 0,1 мг.
2)СФМ по р-ции с бриллиантовым зеленым(обр-е ассоциата)
Количественное определение 1)сурьмы основано на фотоэлектро-колориметрическом (или визуальном) определении по комплексу гексахлорсурьмиата (SbCl6)~ с малахитовым или бриллиантовым зеленым, экстрагируемому толуолом. Граница определения 0,1 мг.
2)СФМ по р-ции с бриллиантовым зеленым(обр-е ассоциата)
 Реакция с хлоридом цезия и иодидом калия. образуются желто-зеленые игольчатые кристаллы, собранные в виде сфероидов:
Реакция с хлоридом цезия и иодидом калия. образуются желто-зеленые игольчатые кристаллы, собранные в виде сфероидов:
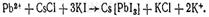 Реакция с ацетатом меди и нитритом калия.Образование черных или коричневых кристалликов, имеющих форму куба
Реакция с ацетатом меди и нитритом калия.Образование черных или коричневых кристалликов, имеющих форму куба
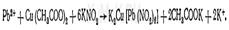 Количественное определение:
а) бихроматно-йодометрическим по избытку бихромата.
2РЬ(ОСОСН3)2 + К2Сг207 + НОН = 2РЬСЮ4 + 2СН3СООК + 2СИ3СООН;
К2Сг207 + 6KI + 7H2S04 = 3I2 + Cr2(S04)3 + 4K2S04 + 7Н20,
I2 + 2Na2S203 = 2NaI + Na2S40s
б) экстракционно-фотометрически по дитизонату свинца.
Pb(0C0CH3)2 + 2H2Dz (при рН 7-10) = Pb(HDz)2 + 2СН3С00Н.
в) комплексонометрическим
Йодометрически удается определить до 1 мг ТЭС в исследуемой навеске
Количественное определение:
а) бихроматно-йодометрическим по избытку бихромата.
2РЬ(ОСОСН3)2 + К2Сг207 + НОН = 2РЬСЮ4 + 2СН3СООК + 2СИ3СООН;
К2Сг207 + 6KI + 7H2S04 = 3I2 + Cr2(S04)3 + 4K2S04 + 7Н20,
I2 + 2Na2S203 = 2NaI + Na2S40s
б) экстракционно-фотометрически по дитизонату свинца.
Pb(0C0CH3)2 + 2H2Dz (при рН 7-10) = Pb(HDz)2 + 2СН3С00Н.
в) комплексонометрическим
Йодометрически удается определить до 1 мг ТЭС в исследуемой навеске
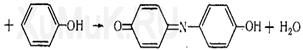
 Индофеноловая реакция.
Индофеноловая реакция.
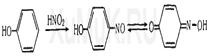
 Реакция Либермана. образуется индофенол, имеющий синюю окраску:
Реакция Либермана. образуется индофенол, имеющий синюю окраску:


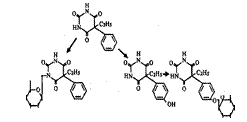 М-д ВАЛОВА.
100 г измельченного биологического материала + 180 мл воды и 20 мл 10 %-го раствора гидроксида натрия 30 мин при частом перемешивании центрифугируют 30 мин надосадочная жидкость + 120 мл 10 %-го раствора вольфрамата натрия и 1 н. раствор серной кислоты (до рН=2) нагревают на кипящей водяной бане 20 мин центрифугирование центрифугат процеживают через ватный тампон собирают в делительную воронку + диэтиловый эфирэфирный слой + 50 мл 10%-го гидроксида натрия водный слой отделяют + 25 %-ным раствор серной кислоты до рН=2 + диэтиловый эфир эфирная вытяжка
Подтверждающие исследования
Цветные реакции:
• с аммиачным раствором нитрата кобальта. розово-фиолетовое окрашивание.
М-д ВАЛОВА.
100 г измельченного биологического материала + 180 мл воды и 20 мл 10 %-го раствора гидроксида натрия 30 мин при частом перемешивании центрифугируют 30 мин надосадочная жидкость + 120 мл 10 %-го раствора вольфрамата натрия и 1 н. раствор серной кислоты (до рН=2) нагревают на кипящей водяной бане 20 мин центрифугирование центрифугат процеживают через ватный тампон собирают в делительную воронку + диэтиловый эфирэфирный слой + 50 мл 10%-го гидроксида натрия водный слой отделяют + 25 %-ным раствор серной кислоты до рН=2 + диэтиловый эфир эфирная вытяжка
Подтверждающие исследования
Цветные реакции:
• с аммиачным раствором нитрата кобальта. розово-фиолетовое окрашивание.
 •мурексидная проба. розовое и красное окрашивание, которое становится интенсивней при смачивании остатка 25% раствором гидрата окиси аммония.
Микрокристаллоскопические реакции:
•перекристаллизация: на предметное стекло помещают сухой остаток. Через 24 часа наблюдают форму осадка – сферолиты, в виде «ежиков».
•с железоиодидным комплексом.Раствор хлорида окисного железа + конц соляная кислота + калия иодид. образование сростков кристаллов.
Количественное определение
ГЖХ-анализ
Условия газохроматографического анализаГазовый хроматограф с термоаэрозольным детектором (ТАД) или с беспламенным азотно-фосфорным детектором (NPD). Температура термостата колонки изменяется по линейной программе от 130 до 290ºС
Подготовка пробы:
0,2 мл плазмы/мочи + 1,3 мл воды и ацетатного буфера + смесь этилацетат/диэтиловый эфир à встряхивание 5 минут à центрифугирование à отделение органики à упаривание + ТМАГ à метилирование барбитуратов
ВЭЖХ -анализ
Условия хроматографирования:
• хроматограф жидкостный
• хроматографическая колонка (6282 мм), заполненная обращено-фазным сорбентом Сепарон
• подвижная фаза - элюент - смесь 0,05М водного раствора двузамещенного фосфата аммония и метанола (60:40)
• скорость потока элюирования - 100 мкл/мин
• детектирование - при длине волны 240 нм.
Подготовка пробы: кровь/моча + стандарт + вода + ацетатный буфер à перемешивание à центрифугирование à упаривание органики à анализ
СФМ
Метод основан на лактим-тактамной таутомерии барбитурата.
•мурексидная проба. розовое и красное окрашивание, которое становится интенсивней при смачивании остатка 25% раствором гидрата окиси аммония.
Микрокристаллоскопические реакции:
•перекристаллизация: на предметное стекло помещают сухой остаток. Через 24 часа наблюдают форму осадка – сферолиты, в виде «ежиков».
•с железоиодидным комплексом.Раствор хлорида окисного железа + конц соляная кислота + калия иодид. образование сростков кристаллов.
Количественное определение
ГЖХ-анализ
Условия газохроматографического анализаГазовый хроматограф с термоаэрозольным детектором (ТАД) или с беспламенным азотно-фосфорным детектором (NPD). Температура термостата колонки изменяется по линейной программе от 130 до 290ºС
Подготовка пробы:
0,2 мл плазмы/мочи + 1,3 мл воды и ацетатного буфера + смесь этилацетат/диэтиловый эфир à встряхивание 5 минут à центрифугирование à отделение органики à упаривание + ТМАГ à метилирование барбитуратов
ВЭЖХ -анализ
Условия хроматографирования:
• хроматограф жидкостный
• хроматографическая колонка (6282 мм), заполненная обращено-фазным сорбентом Сепарон
• подвижная фаза - элюент - смесь 0,05М водного раствора двузамещенного фосфата аммония и метанола (60:40)
• скорость потока элюирования - 100 мкл/мин
• детектирование - при длине волны 240 нм.
Подготовка пробы: кровь/моча + стандарт + вода + ацетатный буфер à перемешивание à центрифугирование à упаривание органики à анализ
СФМ
Метод основан на лактим-тактамной таутомерии барбитурата.
 На графиках D от λ происходит сдвиг максимумов (батохромный сдвиг)
На 1 графике гипербола, на втором – дуга с максимумом 240нм, на третьем дуга 250 нм.
Методика: чпсть кислого хлороформного извлечения выпаривают досуха, сухой остаток растворяют в воде и + несколько капелль NH4OH (или растворяют в боратном буфере до рН=10). Снимают спектр полученного раствора (220нм-280нм). Р-р сравнения – растворитель. Затем в обе кюветы + 1-2 капли насыщенного NH4OH до рН=13,0 и вновь снимают спектр.
Далее строят график (2 и 3 на одном графике) где спектры поглощения пересекаются в 3-х изобестических точках.
На графиках D от λ происходит сдвиг максимумов (батохромный сдвиг)
На 1 графике гипербола, на втором – дуга с максимумом 240нм, на третьем дуга 250 нм.
Методика: чпсть кислого хлороформного извлечения выпаривают досуха, сухой остаток растворяют в воде и + несколько капелль NH4OH (или растворяют в боратном буфере до рН=10). Снимают спектр полученного раствора (220нм-280нм). Р-р сравнения – растворитель. Затем в обе кюветы + 1-2 капли насыщенного NH4OH до рН=13,0 и вновь снимают спектр.
Далее строят график (2 и 3 на одном графике) где спектры поглощения пересекаются в 3-х изобестических точках.
 Реакция этерификации. специфический запах
Реакция образования уксусно-этилового эфира.
2CH 3 COONa + 2C 2H 5OH + H 2 SO 4 ---> 2СН 3 СООС 2 Н 5 +Na 2 SO 4 +2H 2O
2. Реакция образования этилбензоата.
Реакция этерификации. специфический запах
Реакция образования уксусно-этилового эфира.
2CH 3 COONa + 2C 2H 5OH + H 2 SO 4 ---> 2СН 3 СООС 2 Н 5 +Na 2 SO 4 +2H 2O
2. Реакция образования этилбензоата.
 Реакция образования ацетальдегида. Этиловый спирт окисляется дихроматом калия, перманганатом калия до ацетальдегида:
ЗС 2Н 5ОН +К 2Cr 2O 7, + 4H2SO 4 ---> 3СН 3СНО + Cr 2 (SO 4) 3 + K 2 SO 4 + 7R 2O (при t) – Оранжевый цвет ->зеленый, запах резаных яблок.
Ацетальдегид с нитропруссидом натрия и морфолином. появляется синяя окраска.
На исследование в наркодиспансер необходимо прислать кровь и мочу, т.к. забор крови может быть сделан небыстро, а время элиминации этанола – 15-20 часов.
Для судебно-медицинской экспертизы: кровь, моча. При пожаре: мышечная ткань или головной мозг (для определения ацетальдегида), содержимое желудка.
Изолирование: макро и микродистилляция (из биологического материала). Из крови и мочи – алкилнитритный метод газохроматографией (получаем более летучие жидкости, чем исходные спирты).
NaNO2 + CCl3-COOH à HNO2 + CCl3-COONa
HNO2 + ROH à RONO + H2O
Трихлоруксусная (ТХУ) кислота необходима для осаждения белка и образования HNO2
Количественное определение в крови и моче методом ГЖХ АЛКИЛНИТРИТНЫЙ МЕТОД
применяют метод внутреннего стандарта (пропиловый спирт). этиловый спирт и пропиловый спирт переводят в более летучие соединения (в этилнитрит и пропилнитрит). Смесь этилнитрита и пропилнитрита вводят в дозатор хроматографа и проводят хроматографирование. При этом на хроматограмме выписывается два пика, один из которых соответствует этиловому спирту (этилнитриту), а второй — пропиловому спирту (пропилнитриту).
по расстоянию или времени удерживания).
В пенициллиновый флакон помещают 0,5 мл 50% ТХУ, 1 мл крови или мочи, вводят внутренний стандарт (1 мл 4‰ раствора пропанола или изопропанола), флакон закрывают, укупоривают металлическим колпачком под обкатку или пенициллиновый флакон помещают в металлический стакан, плотно закрывая навинчивающейся крышкой с отверстием для шприца. Шприцом вводят 0,5 мл раствора NaNO2, встряхивают (греть не надо). Чистым шприцом отбирают газовую фазу и вводят в хроматограф. На получившейся хроматограмме определяют высоту или площадь пика анализируемого спирта и стандарта. Находят отношение и определяют концентрацию по калибровочному графику.
Реакция образования ацетальдегида. Этиловый спирт окисляется дихроматом калия, перманганатом калия до ацетальдегида:
ЗС 2Н 5ОН +К 2Cr 2O 7, + 4H2SO 4 ---> 3СН 3СНО + Cr 2 (SO 4) 3 + K 2 SO 4 + 7R 2O (при t) – Оранжевый цвет ->зеленый, запах резаных яблок.
Ацетальдегид с нитропруссидом натрия и морфолином. появляется синяя окраска.
На исследование в наркодиспансер необходимо прислать кровь и мочу, т.к. забор крови может быть сделан небыстро, а время элиминации этанола – 15-20 часов.
Для судебно-медицинской экспертизы: кровь, моча. При пожаре: мышечная ткань или головной мозг (для определения ацетальдегида), содержимое желудка.
Изолирование: макро и микродистилляция (из биологического материала). Из крови и мочи – алкилнитритный метод газохроматографией (получаем более летучие жидкости, чем исходные спирты).
NaNO2 + CCl3-COOH à HNO2 + CCl3-COONa
HNO2 + ROH à RONO + H2O
Трихлоруксусная (ТХУ) кислота необходима для осаждения белка и образования HNO2
Количественное определение в крови и моче методом ГЖХ АЛКИЛНИТРИТНЫЙ МЕТОД
применяют метод внутреннего стандарта (пропиловый спирт). этиловый спирт и пропиловый спирт переводят в более летучие соединения (в этилнитрит и пропилнитрит). Смесь этилнитрита и пропилнитрита вводят в дозатор хроматографа и проводят хроматографирование. При этом на хроматограмме выписывается два пика, один из которых соответствует этиловому спирту (этилнитриту), а второй — пропиловому спирту (пропилнитриту).
по расстоянию или времени удерживания).
В пенициллиновый флакон помещают 0,5 мл 50% ТХУ, 1 мл крови или мочи, вводят внутренний стандарт (1 мл 4‰ раствора пропанола или изопропанола), флакон закрывают, укупоривают металлическим колпачком под обкатку или пенициллиновый флакон помещают в металлический стакан, плотно закрывая навинчивающейся крышкой с отверстием для шприца. Шприцом вводят 0,5 мл раствора NaNO2, встряхивают (греть не надо). Чистым шприцом отбирают газовую фазу и вводят в хроматограф. На получившейся хроматограмме определяют высоту или площадь пика анализируемого спирта и стандарта. Находят отношение и определяют концентрацию по калибровочному графику.

 Выделение этиленгликоля из биологического материала.метод основан на использовании бензола как селективного переносчика этиленгликоля из объектов в дистиллят. Бензол совместно с парами этиленгликоля и небольшим количеством водяного пара переносится в дистиллят. Вода, которая перегоняется при этом, практически содержит весь этиленгликоль.
На исследование берут печень трупа, в которой после отравления содержится больше этиленгликоля, чем в других органах. прибавляют 5 г кристаллической щавелевой кислоты, колбу устанавливают на водяную баню и нагревают. Пары бензола и увлекаемые им вода и этиленгликоль конденсируются в холодильнике и попадают в специальное приспособление. Поскольку в этом приспособлении (насадке) бензол (плотностью 0,879) находится сверху воды, он стекает в колбу. Вода и находящийся в ней этиленгликоль остаются в насадке. После окончания отгонки разбирают прибор и пипеткой из насадки отбирают необходимое для анализа количество жидкости. Объекты на исследование: кровь, моча. При летальном исходе: б/ж и стенка мочевого пузыря.
Изолирование:
1) Макродистилляция – извлекается не более 2%
2) Макродистилляция с селективным уносчиком бензолом – извлекается 6-7%.
3) Прямая экстракция бензолом – 5-10%
4) Основной метод – метод Гуляевой (до 70%). Стенку мочевого пузыря измельчают и добавляют ацетон, который глубоко проникает в биоткань и одновременно осаждает белки для очистки извлечения используют активированный уголь. Извлечение фильтруют, испаряют ацетон, а получившийся раствор анализируют методом ГЖХ (детектор – ДИП)
Для крови – аналогично.
Для мочи – концентрируют мочу на водяной бане, добавляют активированный уголь, отфильтровывают и анализируют методом ГЖХ.
Идентификация:
ТСХ на пластине «силуфол». Детекция KMnO4 или Br2. Метод носит отрицательное судебно-медицинское значение и может быть использован также в сочетании с другими методами.
Химические методы:
Обнаружение этиленгликоля.
Реакция окисления этиленгликоля периодатом и обнаружение образовавшегося формальдегида.
Выделение этиленгликоля из биологического материала.метод основан на использовании бензола как селективного переносчика этиленгликоля из объектов в дистиллят. Бензол совместно с парами этиленгликоля и небольшим количеством водяного пара переносится в дистиллят. Вода, которая перегоняется при этом, практически содержит весь этиленгликоль.
На исследование берут печень трупа, в которой после отравления содержится больше этиленгликоля, чем в других органах. прибавляют 5 г кристаллической щавелевой кислоты, колбу устанавливают на водяную баню и нагревают. Пары бензола и увлекаемые им вода и этиленгликоль конденсируются в холодильнике и попадают в специальное приспособление. Поскольку в этом приспособлении (насадке) бензол (плотностью 0,879) находится сверху воды, он стекает в колбу. Вода и находящийся в ней этиленгликоль остаются в насадке. После окончания отгонки разбирают прибор и пипеткой из насадки отбирают необходимое для анализа количество жидкости. Объекты на исследование: кровь, моча. При летальном исходе: б/ж и стенка мочевого пузыря.
Изолирование:
1) Макродистилляция – извлекается не более 2%
2) Макродистилляция с селективным уносчиком бензолом – извлекается 6-7%.
3) Прямая экстракция бензолом – 5-10%
4) Основной метод – метод Гуляевой (до 70%). Стенку мочевого пузыря измельчают и добавляют ацетон, который глубоко проникает в биоткань и одновременно осаждает белки для очистки извлечения используют активированный уголь. Извлечение фильтруют, испаряют ацетон, а получившийся раствор анализируют методом ГЖХ (детектор – ДИП)
Для крови – аналогично.
Для мочи – концентрируют мочу на водяной бане, добавляют активированный уголь, отфильтровывают и анализируют методом ГЖХ.
Идентификация:
ТСХ на пластине «силуфол». Детекция KMnO4 или Br2. Метод носит отрицательное судебно-медицинское значение и может быть использован также в сочетании с другими методами.
Химические методы:
Обнаружение этиленгликоля.
Реакция окисления этиленгликоля периодатом и обнаружение образовавшегося формальдегида.
 Окисление этиленгликоля азотной кислотой и обнаружение щавелевой кислоты.щавелевая кислота с солями кальция образует кристаллы
Окисление этиленгликоля азотной кислотой и обнаружение щавелевой кислоты.щавелевая кислота с солями кальция образует кристаллы
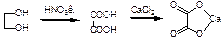 Выпадет осадок в виде характерных кристаллов.
Реакция с сульфатом меди.образуется соединение, имеющее синюю окраску: (для вещдоков)
Выпадет осадок в виде характерных кристаллов.
Реакция с сульфатом меди.образуется соединение, имеющее синюю окраску: (для вещдоков)
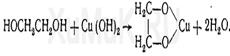 К.О.:ГЖХ
Внутренний стандарт: 1,2-пропиленгликоль. Детектор – ДИП,
АЛКИЛНИТРИТНЫЙ МЕТОД
(по расстоянию или времени удерживания).
В пенициллиновый флакон помещают 0,5 мл 50% ТХУ, 1 мл крови или мочи, вводят внутренний стандарт (1 мл 4‰ раствора пропанола или изопропанола), флакон закрывают, укупоривают металлическим колпачком под обкатку или пенициллиновый флакон помещают в металлический стакан, плотно закрывая навинчивающейся крышкой с отверстием для шприца. Шприцом вводят 0,5 мл раствора NaNO2, встряхивают (греть не надо). Чистым шприцом отбирают газовую фазу и вводят в хроматограф. На получившейся хроматограмме определяют высоту или площадь пика анализируемого спирта и стандарта. Находят отношение и определяют концентрацию по калибровочному графику.
К.О.:ГЖХ
Внутренний стандарт: 1,2-пропиленгликоль. Детектор – ДИП,
АЛКИЛНИТРИТНЫЙ МЕТОД
(по расстоянию или времени удерживания).
В пенициллиновый флакон помещают 0,5 мл 50% ТХУ, 1 мл крови или мочи, вводят внутренний стандарт (1 мл 4‰ раствора пропанола или изопропанола), флакон закрывают, укупоривают металлическим колпачком под обкатку или пенициллиновый флакон помещают в металлический стакан, плотно закрывая навинчивающейся крышкой с отверстием для шприца. Шприцом вводят 0,5 мл раствора NaNO2, встряхивают (греть не надо). Чистым шприцом отбирают газовую фазу и вводят в хроматограф. На получившейся хроматограмме определяют высоту или площадь пика анализируемого спирта и стандарта. Находят отношение и определяют концентрацию по калибровочному графику.
 Реакция с фуксинсернистой кислотой.дает сине-фиолетовую окраску.
Реакция с фуксинсернистой кислотой.дает сине-фиолетовую окраску.
 Реакция с метиловым фиолетовым.дает сине-фиолетовую окраску.
Реакция с кодеином и серной кислотой. под влиянием конц серной кислоты образуется морфин, При взаимодействии морфина с формальдегидом появляется синяя окраска.
Реакция с резорцином. в щелочной среде – розовое или малиновое окрашивание
(“-“ СХЗ)
Реакция с метиловым фиолетовым.дает сине-фиолетовую окраску.
Реакция с кодеином и серной кислотой. под влиянием конц серной кислоты образуется морфин, При взаимодействии морфина с формальдегидом появляется синяя окраска.
Реакция с резорцином. в щелочной среде – розовое или малиновое окрашивание
(“-“ СХЗ)
 Реакция восстановления ионов серебра. серый осадок или “серебрянное зеркало”
Реакция восстановления ионов серебра. серый осадок или “серебрянное зеркало”
 Реакция с реактивом Фелинга. При нагревании реактива Фелинга с формальдегидом выпадает осадок оксида или гидроксида меди.
желтый осадок à коричневый
Реакция с реактивом Фелинга. При нагревании реактива Фелинга с формальдегидом выпадает осадок оксида или гидроксида меди.
желтый осадок à коричневый
 Схема анализа дистиллята:
50 мл. дистиллята:
1) С резорцином
а) Хлорорганика
б) Формальдегид
Хлорорганика – отщепление органически связанного хлора.
Формальдегид – фуксинсернистая кислота.
2) Образование йодоформа.
а) ацетон – нитропруссидом Na.
б) Этанол – образование этилацетата (или окисление).
3) Высшие спирты (пробоподготовка) – реакция Комаровского.
4) Метанол – окисление до формальдегида, анализ формальдегида.
5) Синильная кислота. Первую порцию дистиллята мы собираем в раствор щелочи.
а) Образование берлинской лазури.
б) с пиридинбензидиновым реактивом.
6) Фенол (пробоподготовка)
а) С бромной водой.
б) с FeCl3.
ГЖХ по абсолютному или относительному расстоянию удерживания. Катарометр для летучих ядов, которые дают газовую фазу (нельзя запускать формальдегид, фенол, хлоралгидрат). Дип – можно запускать дистиллят, для всех летучих ядов.
Схема анализа дистиллята:
50 мл. дистиллята:
1) С резорцином
а) Хлорорганика
б) Формальдегид
Хлорорганика – отщепление органически связанного хлора.
Формальдегид – фуксинсернистая кислота.
2) Образование йодоформа.
а) ацетон – нитропруссидом Na.
б) Этанол – образование этилацетата (или окисление).
3) Высшие спирты (пробоподготовка) – реакция Комаровского.
4) Метанол – окисление до формальдегида, анализ формальдегида.
5) Синильная кислота. Первую порцию дистиллята мы собираем в раствор щелочи.
а) Образование берлинской лазури.
б) с пиридинбензидиновым реактивом.
6) Фенол (пробоподготовка)
а) С бромной водой.
б) с FeCl3.
ГЖХ по абсолютному или относительному расстоянию удерживания. Катарометр для летучих ядов, которые дают газовую фазу (нельзя запускать формальдегид, фенол, хлоралгидрат). Дип – можно запускать дистиллят, для всех летучих ядов.
 Хлороформный слой окрашивается в розово-красный цвет с фиолетовым оттенком.
Если эффект есть, к минерализату добавляют (ДДТК)Na для концентрирования Zn.
ZnSO4 + (ДДТК)Na
Хлороформный слой окрашивается в розово-красный цвет с фиолетовым оттенком.
Если эффект есть, к минерализату добавляют (ДДТК)Na для концентрирования Zn.
ZnSO4 + (ДДТК)Na  (ДДТК)2Zn + Na2SO4.
Хлороформный слой отделяют и добавляют раствор HCl
(ДДТК)2Zn + 2HCl à 2ДДТКH + ZnCl2
Хлороформный слой отбрасывают, с реэкстрактом проводят реакции:
Выделение ионов цинка из минерализата.От прибавления раствора диэтилдитиокарбамата натрия к минерализату образуется внутрикомплексное соединение:
(ДДТК)2Zn + Na2SO4.
Хлороформный слой отделяют и добавляют раствор HCl
(ДДТК)2Zn + 2HCl à 2ДДТКH + ZnCl2
Хлороформный слой отбрасывают, с реэкстрактом проводят реакции:
Выделение ионов цинка из минерализата.От прибавления раствора диэтилдитиокарбамата натрия к минерализату образуется внутрикомплексное соединение:
 ZnCl2 + Na2S à ZnS↓ + 2NaCl
Белый осадок.
Реакция с гексацианоферратом (II) калия. К 1 мл водной фазы добавляют 5 %-й раствор гидроксида калия до рН = 5 (по универсальному индикатору) и 3—4 капли 5 %-го раствора гексацианоферрата (II) калия. выделяется белый осадок:
ZnCl2 + Na2S à ZnS↓ + 2NaCl
Белый осадок.
Реакция с гексацианоферратом (II) калия. К 1 мл водной фазы добавляют 5 %-й раствор гидроксида калия до рН = 5 (по универсальному индикатору) и 3—4 капли 5 %-го раствора гексацианоферрата (II) калия. выделяется белый осадок:
 При добавлении избытка реактива может образоваться более растворимый осадок [Zn 2 [Fe(C
При добавлении избытка реактива может образоваться более растворимый осадок [Zn 2 [Fe(C