Кинетика химических процессов.
Кинетика биологических процессов изучает поведение во времени самых разнообразных процессов, присущих различным условиям живой материи: биохимические превращения в клетке, генерацию электрического потенциала на биологических мембранах, биологические ритмы, процессы накопления биомассы или размножения вида, взаимодействия популяции живых организмов в биоценозах. В этом определении охвачен широкий спектр уровней сложности рассматриваемых систем от молекулярного до ценотического. Общим для всех процессов считается «поведение во времени».
ЭЛЕМЕНТАРНЫЕ КИНЕТИЧЕСКИЕ УРАВНЕНИЯ И ИХ РЕШЕНИЕ
Здесь будут рассмотрены кинетические уравнения, которые первоначально были получены в химической кинетике. Это - дифференциальные уравнения, в левой части которых стоит скорость изменения во времени концентрации какого-либо вещества. Правая часть уравнения составляется на основе закона действующих масс, согласно которому скорость элементарной стадии химической реакции при постоянной температуре пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в химическом уравнении этой стадии. Закон действующих масс является макроскопическим выражением статистического механизма взаимодействий на молекулярном уровне, который в упрощенном виде можно представить так. Для того, чтобы два атома или две молекулы химически прореагировали друг с другом, они должны встретиться. Скорость реакции должна быть пропорциональной числу встреч или столкновении в единицу времени. Очевидно, что чем больше концентрация каждого из реагирующих веществ, тем больше число столкновении. Следовательно, скорость химической реакции пропорциональна концентрациям реагирующих веществ.
Соотношения, подобные закону действующих масс, могут хотя бы в самом грубом приближении оказаться полезной моделью процессов, происходящих в системах, элементами которых могут быть самые разнообразные объекты органического происхождения.
Наибольшая степень, в которой концентрации входят в правую часть кинетического уравнения, определяет порядок реакции.
Реакции нулевого порядка
Если скорость реакции не зависит от концентрации участвующих в реакции реагентов, ее называют реакцией нулевого порядка.
Пусть вещество А превращается в вещество В со скоростью, не зависящей от наличной концентрации вещества А. Запишем химическое уравнение
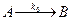
Обозначим строчными буквами концентрации a и b, получим кинетические уравнения


Здесь  - константа скорости реакции нулевого порядка.
- константа скорости реакции нулевого порядка.
Решения этих уравнений представляют собой лишенные функции от времени

 и
и  – константы интегрирования, которые можно найти, задав начальные условия (например, при
– константы интегрирования, которые можно найти, задав начальные условия (например, при  и
и  ).
).
Ситуацией, когда скорость реакции не зависит от концентрации реагента, являются условия, при которых количество реагента столь велико, что не лимитирует протекание процесса с максимальной скоростью, определяемой константой  . В открытых системах может реализоваться случаи, когда концентрация субстрата поддерживается постоянной и параметрически задает постоянной скорость процесса. Наглядным примером такой ситуации является опыт английского исследователя Г. Дейла, в котором он получил доказательство непрямого действия ионизирующего излучения на органические соединения, т. е. опосредованного образованием продуктов радиолиза молекул воды — свободными радикалами. Альтернативой такому действию была другая возможность - прямого ионизирующего действия на облучаемые объекты. Опыт состоял в следующем.
. В открытых системах может реализоваться случаи, когда концентрация субстрата поддерживается постоянной и параметрически задает постоянной скорость процесса. Наглядным примером такой ситуации является опыт английского исследователя Г. Дейла, в котором он получил доказательство непрямого действия ионизирующего излучения на органические соединения, т. е. опосредованного образованием продуктов радиолиза молекул воды — свободными радикалами. Альтернативой такому действию была другая возможность - прямого ионизирующего действия на облучаемые объекты. Опыт состоял в следующем.
В числе ферментов, расщепляющих в полипептидной цепочке связь между карбоксильной и аминной группой, имеется фермент карбопепсидаза. Водные растворы этого фермента разной концентрации облучали одной и той же дозой ионизирующей радиации. При прямом действии вероятность попадания ионизирующей частицы в молекулу фермента должна с увеличением концентрации фермента возрастать. При косвенном действии число инактивированных молекул фермента должно оставаться одним и тем же независимо от концентрации раствора, так как облучение одной и той же дозой ведет к образованию одинакового числа свободных радикалов, способных прореагировать только с определенным числом молекул фермента. Так оно и оказалось. В широком диапазоне изменении концентрации фермента число инактивированных молекул оставалось постоянным. Этот феномен был назван Дейлом эффектом разбавления.