Практическая работа №2
Тема: «Решение задач на расчет концентраций растворов и рН среды»
Цель работы: 1. Закрепить практические умения и навыки на использование концентраций растворов в химических расчетах, основных законов Рауля и Вант - Гоффа.
- Научиться с помощью ионного произведения воды и водородного показателя определять кислотность среды.
Продолжительность:2 часа
Формируемые знания, умения, общие компетенции: У3, У4,У5,У6,З1, З2, З3,З4,ОК1-4
План работы:
- Расчет концентраций растворов.
- Решение задач на использование законов Рауля и Вант – Гоффа.
- Определение кислотности растворов различных веществ.
Методические рекомендации
Концентрация растворов.
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
- Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
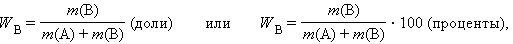
где m (B) и m (A) – масса растворенного вещества B и масса растворителя A.
- Мольная доля растворенного вещества χ(B) выражается соотношением
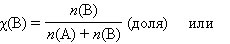

Сумма мольных долей k компонентов раствора χ i равна единице
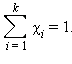
К размерным концентрациям относятся следующие концентрации:
- Моляльность растворенного вещества Cm (B) определяется количеством вещества n (B) в 1 кг (1000 г) растворителя, размерность моль/кг.

- Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:
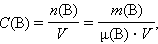
где μ(B) – молярная масса B, V – объем раствора.
- Молярная концентрация эквивалентов вещества B C Э(B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:

где n Э(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
- Титр раствора вещества B(T B) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
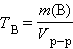
[TB] = г∙мл–1 или
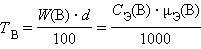
[TB] = г ∙мл–1
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Законы Рауля и Вант – Гоффа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
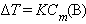
Тогда из Δ T = K кр · m получим молярную массу растворенного вещества:

По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде

Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C (B) в формуле Вант-Гоффа соотношением (m (B) ∙ 1000 / μ(B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:

m (B) – масса растворенного вещества, V – объем раствора
Пример 1. В 175 г воды растворено 25 г CuSO4∙5H2O. Вычислить процентную концентра-цию его в полученном растворе.
Решение. Масса раствора составляет 200 г. В пентагидрате сульфата меди (II) безводного CuSO4 содержится
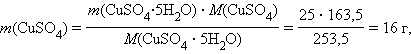
что составляет 16 / 200 · 100 % = 8 %
Пример 2. Определите молярную долю, моляльность, молярную концентрацию, молярную концентрацию эквивалентов и титр 27,7% раствора H2SO4, d = 1,2 г/мл.
Решение.
- Молярная доля χ

- Моляльность Cm
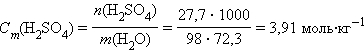
- Молярная концентрация C
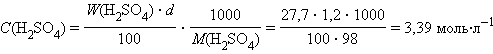
4. Молярная концентрация эквивалентов C Э
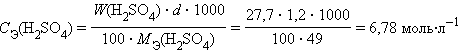
5. Титр T
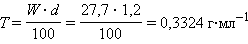
Пример 3. На нейтрализацию 25 мл раствора H2SO4 израсходовано 10 мл 0,1 C Э раствора NaOH. Какова молярная концентрация эквивалентов H2SO4?
Решение. Используя закон эквивалентов C Э(H2SO4) ∙ V (H2SO4) = C Э(NaOH) ∙ V (NaOH), получаем

Пример 4. Определить объем 70 % раствора H3PO4 плотностью 1,5 г/мл, необходимый для приготовления 1,5 л раствора C Э = 0,1 моль·л–1.
Решение. Используя соотношение
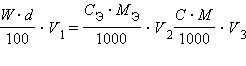
и учитывая, что нужно приготовить раствор с Сэ = 0,1 находим объем V1 исходного раствора H3PO4
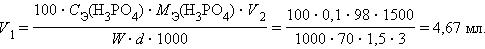
Пример 5. Для заполнения автомобильного аккумулятора необходимо приготовить 2 л 35% серной кислоты плотностью 1,26 г/мл из 98% раствора с d = 1,836 г/мл.
Решение. Задача решается аналогично задаче 4.
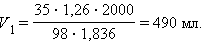
Пример 6. Какова температура кипения раствора 30 г глюкозы (C6H12O6) в 100 мл воды (d = 1,000 г·мл–1)?
Решение. Δ t = K эб · Cm = K эб· m(глюкозы) /М(глюкозы) m (H2O)= 0.52· 30 / 180· 0.1 = 0.87 оС
t кип раствора C6H12O6 100,87°C.
Пример 7. Температура замерзания раствора 0,400 г неизвестного углеводорода в 25,0 г уксусной кислоты понизилась на 0,45°C по сравнению с чистой CH3COOH (K = 3,6 град·моль–1·кг). Какова молярная масса исследуемого углеводорода? Какова его формула, если по данным анализа содержание C = 93,76%; H = 6,25%?
Решение.
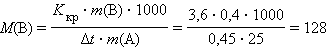
Σ M (C) = 0,9376 ∙ M (B) = 120; n (C) = 120: 12 = 10
Σ M (H) = 0,0624 ∙ M (B) = 8,0; n (H) = 8,0: 1,0 = 8
C10H8 (нафталин).
Пример 8. Образец поливинилхлорида массой 4,00 г с M = 1,5∙105г∙моль–1 растворили в 0,1 лдиоксана, C4H8O2 при 298К. Каково осмотическое давление, возникающее в растворе по сравнению с чистымдиоксаном?
Решение. π = CRT = 4 · 8.31 · 298 / 1.5 · 105 · 0.1 = 6.6 Па.