Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты.
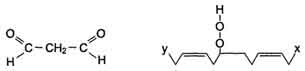
4) Обрыв цепи - взаимодействие радикалов между собой:
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
LOO· + L· → LOOH + LH
L· + vit E → LH + vit E·
vit E· + L· → LH + vit Еокисл.
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии (нарушению притока кислорода), а затем реоксигенации (восстановление притока кислорода), что происходит, например, при спазме коронарных артерий и последующем их расширении.
Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты - вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
Системы защиты клеток от активных форм кислорода:
1. Ферменты антиоксидантного действия (наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико):
1. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода: 2 О2- + 2H+ → H2O2 + O2. СОД находится и в цитозоле и в митохондриях и являются первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление.
2. Каталаза разрушает пероксид водорода, который может инициировать образование самой активной формы ОН-. Каталаза находится, в основном, в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах.
3. Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью глутатиона (он представляет собой трипептид γ-глутамилцистеинилглицин). Окисленный глутатион восстанавливается глутатионредуктазой. Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен[1] (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
2. Витамины, обладающие антиоксидантным действием:
1. Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
2. Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода - О2-, Н2О2, ОН- и инактивирует их.
3. β-Каротин (предшественник витамина А), ретинол (относится к группе веществ витамина А), также обладают антиоксидантным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний сердечно-сосудистой системы, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием.
Биосинтез жирных кислот
Биосинтез насыщенных жирных кислот происходит в направлении, противоположном их β-окислению; наращивание углеводородных цепей жирных кислот осуществляется за счет последовательного присоединения к их концам двухуглеродного фрагмента — ацетил-СоА.
В цитоплазме идет синтез насыщенных кислот с длинной углеводородной цепью до пальмитата (С16), в митохондриях происходит дальнейшее наращивание цепи, на эндоплазматических мембранах насыщенные кислоты превращаются в ненасыщенные.
Синтез жирных кислот происходит в абсорбтивный период. Активный гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Так как синтез жирных кислот происходит в цитозоле клеток, то ацетил-КоА должен быть транспортирован через внутреннюю мембрану митохондрий в цитозоль. Однако внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата при участии цитратсинтазы:
Ацетил-КоА + Оксалоацетат ® Цитрат + HS-КоА.
Затем транслоказа переносит цитрат в цитоплазму. Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH + Н+ и АТФ. Эта ситуация создаётся в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется под действием фермента цитратлиазы:
Цитрат + HS-KoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат.
Далее синтез жирных кислот происходит по следующему сценарию:
1. Образование малонил-СоА.
Образование малонил-КоА из ацетил-КоА - регуляторная реакция в биосинтезе жирных кислот. Эта реакция является реакцией присоединения к ацетил-СоА СО2. Она необратима. В процессе сборки углеводородной цепи молекулы жирной кислоты принимают участие молекулы малонил-СоА, за исключением лишь одной молекулы ацетил-СоА, необходимой в начале синтеза.
Синтез малонил-СоА катализируется биотинзависимой ацетил-СоА- карбоксилазой (Е). Реакция карбоксилирования идет в две стадии. В первой стадии при участии АТР образуется промежуточный продукт — карбоксибиотин:

Затем активированная СО2-группа переносится на ацетил-СоА с образованием малонил-СоА:
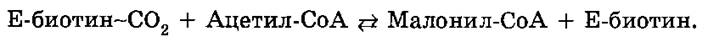
2. Цикл элонгации в синтезе жирных кислот
Реакции цикла элонгации катализируются мультиферментным комплексом, называемым синтетазой жирных кислот (Е). Важной особенностью синтеза жирных кислот является участие в реакциях элонгации промежуточных продуктов синтеза, ковалентно связанных с ацилпереносящим белком (АПБ-SH). В процессе элонгации функция АПБ аналогична функции кофермента А при β-окислении жирных кислот (т.е. он является активатором).
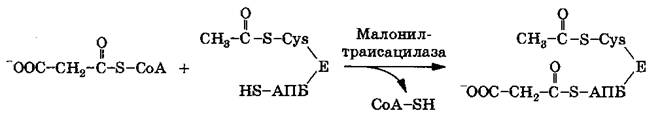
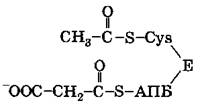
Под действием ацетилтрансацилазы ацетильная группа ацетил-СоА переносится на SH-группу цистеинового остатка (Cys) синтетазы жирных кислот, находящейся в комплексе с АПБ:

Малонильная группа малонил-СоА реагирует с SH-группой АПБ. Эта реакция катализируется малонилтрансацилазой, образуется ацетил-малонил- АПБ:
Далее описанные ниже реакции будут повторяться:
1) реакция конденсации ацетил-СоА с малонил-СоА:
|

|


2) реакция восстановления, катализируется β-кетоацил-АПБ-редуктазой, β кетоацил-АПБ превращается в β-гидроксибутирил-АПБ. Восстанавливающим агентом служит NADPH+Н+.
|
|
|



3) в реакции дегидратации — от β -гидроксибутирил-АПБ отщепляется молекула воды с образованием еноил-АПБ. Реакция катализируется β-гидроксиацил-AПБ-дегидратазой.
|
|



4) реакция восстановления еноил-АПВ в бутирил-АПБ. Реакция идет под действием а, β -еноил-АПВ-редуктазы. Роль восстановителя здесь выполняет вторая молекула NADPH+Н+.
|

|
|



Последовательность реакций элонгации во втором и следующих циклах повторяется. В следующем втором цикле элонгации группа бутирила переносится на SH-группу цистеина синтетазы:
 В синтезе жирной кислоты только одна молекула ацетил-СоА непосредственно вступает в реакцию конденсации, играя роль "затравки", остальные n молекул сначала превращаются в n молекул малонил-СоА, на что используются n молекул АТР. В каждом цикле элонгации требуются 2 молекулы NADPH+Н+ и, следовательно, на n циклов необходимо затратить 2n молекул NADPH+Н+.
В синтезе жирной кислоты только одна молекула ацетил-СоА непосредственно вступает в реакцию конденсации, играя роль "затравки", остальные n молекул сначала превращаются в n молекул малонил-СоА, на что используются n молекул АТР. В каждом цикле элонгации требуются 2 молекулы NADPH+Н+ и, следовательно, на n циклов необходимо затратить 2n молекул NADPH+Н+.
Как правило, процесс элонгации идет вплоть до образования С16-ацил-АПВ. Этот конечный продукт не может служить субстратом для конденсирующего фермента и гидролизуется с образованием пальмитата и АПБ.
Биосинтез липидов
Биосинтез ацилглицеролов. В биосинтезе ацилглицеролов принимают участие два предшественника: ацил-СоА и глицерол-3-фосфат. Глицерол-З-фосфат образуется в результате восстановления дигидроксиацетонфосфата — промежуточного продукта глюконеогенеза и гликолиза, реакцию катализирует глицеролфосфатдегидрогеназа.

Ацил-СоА синтезируется из ацетил-СоА, который образуется двумя путями: либо в результате окислительного декарбоксилирования пирувата — конечного продукта гликолиза, либо в результате расщепления цитрата, поступающего из митохондрий в цитоплазму.
1. На первом этапе синтеза ацилглицерола образуется 3-фосфатидная кислота (диацилглицерол-3-фосфат), при этом ацильные остатки СоА-производных жирных кислот переносятся специфическими ацилтрансферазами на спиртовые группы глицерол-3-фосфата:

2. Фосфатидная кислота гидролизуется фосфатидатфосфатазой с образованием 1,2-диацилглицерола:

3. 1,2-диацилглицерол превращается в триацилглицерол путем переноса ацильного остатка от третьей жирной кислоты. Катализирует ферментом диацилглицеролацилтрансферазой:
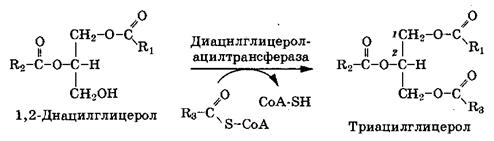
Синтез ацилглицеролов требует затраты большого количества свободной энергии. Для образования одной сложноэфирной связи жирная кислота должна перейти в активную форму ацил-СоА, на что необходима энергия 2 АТФ.
Триацилглицеролы составляют энергетическое депо организма, локализуются в жировых клетках (адипоцитах) и характеризуются высокой скоростью метаболизма.
Биосинтез фосфолипидов. Протекает в мембранах ЭПС. В биосинтезе фосфолипидов ключевым промежуточным соединением является глицерол-3-фосфат, а роль активатора выполняет цитидинтрифосфат (ЦТФ).
1. В процессе синтеза фосфатидилэтаноламина вначале происходит активация этаноламина под действием этаноламинкиназы:

Этаноламинфосфат реагирует затем с цитидинтрифосфатом (ЦТФ), в результате чего образуется цитидиндифосфатэтаноламин и пирофосфат. Эту реакцию катализирует фосфоэтаноламинцитидинтрансфераза:

Активированный ЦДФ-этаноламин при участии фермента этаноламинфосфаттрансферазы вступает в реакцию с L-диацилглицеролом с образованием фосфатидилэтаноламина:

2. Фосфатидилэтаноламин является предшественником фосфатидилхолина. В результате последовательного переноса трех метильных групп от трех молекул S-аденозилметионина (SAM, донор метильных групп) к аминогруппе остатка этаноламина образуется фосфатидилхолин:

Кроме того, есть еще один путь синтеза фосфатидилхолина:
|
|
 Холин + АТФ Фосфохолин + АДФ.
Холин + АТФ Фосфохолин + АДФ.
 Фосфохолин + ЦТФ ЦДФ-холин + РРi.
Фосфохолин + ЦТФ ЦДФ-холин + РРi.

3. У млекопитающих фосфатидилсерин образуется в реакции обмена этаноламина на серин следующим путем:

