Сложные органические вещества
Амины. Аминокислоты. Белок.
План.
1. Амины: номенклатура, важнейшие свойства.
2. Аминоспирты. Их роль в организме человека.
3. Аминокислоты: классификация, номенклатура, свойства, получение и применение.
4. Белки: сложная структура белка, свойства.
1. Амины. Органические вещества, которые содержат только одну функциональную группу - аминогруппу. Их можно рассматривать как производные аммиака, в котором водород замещен на углеводородные радикалы.
Например: СН3- NH2 (метанамин или чаще называют метиламин) или С2Н5- NH2 (этанамин или этиламин). Такие амины называют однозамещенными или первичными.
СН3- NH -СН3 (диметиламин) – двузамещенный или вторичный амин. Существует и трехзамещенные (третичные) амины. С6Н5- NH2 – (фениламин или анилин) относится к ароматическим аминам. Алифатические амины – газообразные (метиламин), жидкие или твердые вещества. Низшие - растворимы в воде и имеют рыбный запах, с увеличением радикала растворимость уменьшается. Анилин – маслянистая жидкость, имеет запах горького миндаля, ядовит, тяжелее воды, и в ней почти не растворяется.
Химические свойства.
А) Аминогруппа обладает основными свойствами (способна принять протон за счет пары электронов азота), поэтому амины называют органическими основаниями. Амины более сильные основания, чем аммиак (алифатические углеродные радикалы являются донорами электронной плотности и увеличивают отрицательный заряд на атоме азота). А вторичные амины более сильные основания, чем первичные, потому что два радикала, создают на азоте еще большую электронную плотность, чем один. Амины взаимодействуют с кислотами, образуя соли.
СН3-NH2+ Н2О →[СН3-NH3+] + ОН-, т.е. в водных растворах аминов будет щелочная среда.
С2Н5-NH2 + HCl → [С2Н5-NH3+] Cl- - хлорид этиламина.
Ароматические амины (например, анилин) - более слабые основания, чем алифатические амины (бензольное кольцо акцептор электронной плотности) и даже аммиак. Анилин не изменяет окраски индикаторов. Но с кислотами анилин тоже может взаимодействовать.
Б) Для аминов, так же как для галогенпроизводных и спиртов, характерны реакции нуклеофильного замещения, т.е. аминогруппу можно заменить на другую нуклеофильную группу (-ОН, Hal-, RО- и т.д.).
R- NH2+ NaOH  R-OH + NaCl
R-OH + NaCl
R-NH2 + NaCl  R- Cl+ NaBr
R- Cl+ NaBr
В) Реакции окисления. Амины горят на воздухе с образованием углекислого газа, воды и азота.
Получение аминов. Основной способ получения аминов восстановление нитрогруппы (реакция Зинина).
Применение. Низшие алифатические амины используют для синтеза лекарств, пестицидов и пластмасс. Но еще шире используется анилин, прежде всего, для синтеза красителей (индиго, фуксин и т.д.). Сам анилин обладает жаропонижающим и обезболивающим действием, но он токсичен. На основе анилина синтезировано множество лекарственных препаратов, например, сульфаниламиды. Самые известные из них – стрептоцид и бисептол. К производным анилина можно отнести парацетамол и новокаин.
2.Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксогруппу.
У одного атома углерода эти группы удерживаются не прочно, происходит отщепление аммиака или воды, поэтому таких соединений не существует. Простейший представитель аминоспиртов-
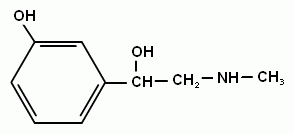
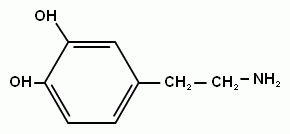
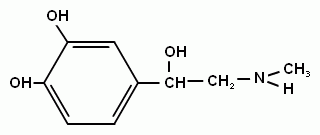
 2-аминоэтанол - структурный компонент сложных липидов. Это вязкая жидкость с высокой температурой кипения. С сильными кислотами в реакцию вступает его аминогруппа и образуются устойчивые соли. Другой аминоспирт – холин – структурный элемент сложных липидов, имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. Его можно рассматривать как производное аминоэтанола. В организме холин может образовываться из аминокислоты серина.
2-аминоэтанол - структурный компонент сложных липидов. Это вязкая жидкость с высокой температурой кипения. С сильными кислотами в реакцию вступает его аминогруппа и образуются устойчивые соли. Другой аминоспирт – холин – структурный элемент сложных липидов, имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. Его можно рассматривать как производное аминоэтанола. В организме холин может образовываться из аминокислоты серина.


→
Биологическая роль сложных эфиров холина. Замещённые фосфаты холина (т.е. сложные эфиры спирта холина и фосфорной кислоты) являются важной структурной частью фосфолипидов – важнейшего строительного материала клеточных мембран. Сложный эфир холина и уксусной кислоты ( ацетилхолин ) – наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А.

 При ингибировании ацетилхолинэстеразы (фермента, который катализирует разложение ацетилхолина), ацетилхолин накапливается в организме. Это приводит к непрерывной передаче нервных импульсов и, соответственно, к непрерывному сокращению мышечной ткани. На этом основано действие инсектицидов и нервнопаралитических ядов (например, зарина). В медицинской практике используется ряд производных холина: ацетилхолинхлорид, карбомоилхолинхлорид – сосудорасширяющие средства и сукцинилхолиниодид – мышечнорасслабляющее средство.
При ингибировании ацетилхолинэстеразы (фермента, который катализирует разложение ацетилхолина), ацетилхолин накапливается в организме. Это приводит к непрерывной передаче нервных импульсов и, соответственно, к непрерывному сокращению мышечной ткани. На этом основано действие инсектицидов и нервнопаралитических ядов (например, зарина). В медицинской практике используется ряд производных холина: ацетилхолинхлорид, карбомоилхолинхлорид – сосудорасширяющие средства и сукцинилхолиниодид – мышечнорасслабляющее средство.

 Важную роль в организме играют аминоспирты, содержащие в качестве структурного фрагмента остаток пирокатехина (1,2-дигидроксибензол). Они носят общее название катехоламинов. Рядом вы видите формулы веществ, участвующих в образовании адреналина (фенилаланин, тирозин, ДОФА, дофамин, норадреналин, адреналин). Дофамин, норадреналин, адреналин выполняют роль нейромедиаторов. Адреналин является гормоном мозгового вещества надпочечников, а два других – его предшественники. Адреналин участвует в регуляции сердечной деятельности, в регуляции обменов углеводов, при физиологических стрессах он выделяется в кровь..
Важную роль в организме играют аминоспирты, содержащие в качестве структурного фрагмента остаток пирокатехина (1,2-дигидроксибензол). Они носят общее название катехоламинов. Рядом вы видите формулы веществ, участвующих в образовании адреналина (фенилаланин, тирозин, ДОФА, дофамин, норадреналин, адреналин). Дофамин, норадреналин, адреналин выполняют роль нейромедиаторов. Адреналин является гормоном мозгового вещества надпочечников, а два других – его предшественники. Адреналин участвует в регуляции сердечной деятельности, в регуляции обменов углеводов, при физиологических стрессах он выделяется в кровь..
Структурно близки к катехоламинам некоторые природные и синтетические БАВ, применяемые в качестве лекарственных средств. Например :
эфедрин (сосудорасширяющее действие ) и мезатон (повышающий давление).


 3.Аминокислоты содержат в молекуле одновременно карбоксильную группу и аминогруппу. Например: 4-амино-бутановая кислота. Для аминокислот в биохимии и медицине часто используют традиционные названия. В зависимости от расположения этих групп различают
3.Аминокислоты содержат в молекуле одновременно карбоксильную группу и аминогруппу. Например: 4-амино-бутановая кислота. Для аминокислот в биохимии и медицине часто используют традиционные названия. В зависимости от расположения этих групп различают  и т. д. аминокислоты. Нумерацию начинают со второго атома и используют греческий алфавит. Названия кислот в этом случае – тоже традиционные, т.е. уксусная, пропионовая, масляная, валерьяновая и т.д. 4-аминобутановая кислота будет называться
и т. д. аминокислоты. Нумерацию начинают со второго атома и используют греческий алфавит. Названия кислот в этом случае – тоже традиционные, т.е. уксусная, пропионовая, масляная, валерьяновая и т.д. 4-аминобутановая кислота будет называться 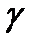 -аминомасляной кислотой. ГАМК принимает участие в обменных процессах головного мозга, является нейромедиатором. Применяется под названием гаммалон при лечении заболеваний ЦНС.
-аминомасляной кислотой. ГАМК принимает участие в обменных процессах головного мозга, является нейромедиатором. Применяется под названием гаммалон при лечении заболеваний ЦНС.
Структура ГАМК лежит в основе транквилизатора финилбута. Амид ГАМК (пирацетам, ноотропил) рассматривается как первый представитель ноотропных, т. е. влияющих на мышление веществ.
Особое значение в органическом мире имеют  -аминокислоты, из их остатков состоят пептиды и белки. Общее число встречающихся в живых организмах аминокислот около 300, однако, некоторые обнаружены только в определённых организмах. Можно выделить группу из 20
-аминокислоты, из их остатков состоят пептиды и белки. Общее число встречающихся в живых организмах аминокислот около 300, однако, некоторые обнаружены только в определённых организмах. Можно выделить группу из 20  -аминокислот постоянно встречающихся во всех белках (см. таблица аминокислот). Их называют природными аминокислотами. Причем почти все природные аминокислоты принадлежат L ряду оптических изомеров. Общую формулу
-аминокислот постоянно встречающихся во всех белках (см. таблица аминокислот). Их называют природными аминокислотами. Причем почти все природные аминокислоты принадлежат L ряду оптических изомеров. Общую формулу  -аминокислот можно записать так: Природные аминокислоты классифицируют по различным признакам. Например, по химической природе радикала: алифатические, ароматические и гетероциклические. В алифатическом радикале могут содержаться функциональные группы. Поэтому среди аминокислот выделяют нейтральные, основные и кислые кислоты, в зависимости от числа кислотных и основных групп. Характер бокового радикала может быть неполярный или полярный. Неполярные – это аминокислоты с алифатическим и ароматическим радикалом, полярные – имеют функциональные группы способные переходить в ионное состояние. Многие аминокислоты синтезируются в организме, но некоторые обязательно должны поступать извне, т.к. в организме они не могут синтезироваться. Такие аминокислоты называют незаменимыми: валин, лейцин, изолейцин, лизин, трионин, метионин,
-аминокислот можно записать так: Природные аминокислоты классифицируют по различным признакам. Например, по химической природе радикала: алифатические, ароматические и гетероциклические. В алифатическом радикале могут содержаться функциональные группы. Поэтому среди аминокислот выделяют нейтральные, основные и кислые кислоты, в зависимости от числа кислотных и основных групп. Характер бокового радикала может быть неполярный или полярный. Неполярные – это аминокислоты с алифатическим и ароматическим радикалом, полярные – имеют функциональные группы способные переходить в ионное состояние. Многие аминокислоты синтезируются в организме, но некоторые обязательно должны поступать извне, т.к. в организме они не могут синтезироваться. Такие аминокислоты называют незаменимыми: валин, лейцин, изолейцин, лизин, трионин, метионин,  фенилаланин, триптофан. Они обязательно должны содержаться в пище, т.к. нехватка даже одной из незаменимых кислот может привести к тяжелым нарушениям белкового обмена и серьезным заболеваниям.
фенилаланин, триптофан. Они обязательно должны содержаться в пище, т.к. нехватка даже одной из незаменимых кислот может привести к тяжелым нарушениям белкового обмена и серьезным заболеваниям.
Физические свойства. Все аминокислоты - это кристаллические вещества растворимые в воде, многие имеют сладкий вкус, некоторые безвкусны, есть кислые или имеют вкус мяса (глутаминовая).
Химические свойства.
А) Аминокислоты гетеро- функциональные соединения. За счет группы –СООН проходят реакции характерные для карбоновых кислот (т.е. кислотные свойства, образо-вание сложных эфиров…). За счет аминогруппы проходят реакции, в которых аминокислота проявляет основные свойства, т.е. участвует в реакциях нуклеофильного обмена аминогруппы.
Наличие основной и кислотной группы одновременно делает аминокислоты амфотерными соединениями, т.е. способными вступать в реакцию и с кислотами и со щелочами.
NH2- CH2 -CH2-COOH + NaOH →NH2- CH2 - CH2-COONa + H2O – кислотные свойства
NH2- CH2 CH2-COOH + HCl → Cl-[+NH3- CH2 -CH2-COOH] - основные свойства
В твёрдом состоянии и в водных растворах аминокислоты существуют в виде биполярных ионов. При этом среда в растворе остается нейтральной. Если, конечно, в радикале нет дополнительных кислотных или аминогрупп. В кислой или щелочной среде молекула аминокислоты существует в виде катиона или аниона.
NH2- CH2 CH2-COOH ↔ +NH3- CH2 -CH2-COO-
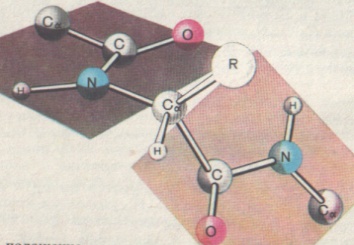
Б) Аминогруппа одной молекулы может взаимодействовать с карбоксильной группой другой молекулы. При этом образуется более сложная молекула и выделяется низкомолекулярное вещество – вода. Такую реакцию называют конденсацией, ее можно рассматривать, как реакцию нуклеофильного замещения гидроксогруппы в молекуле аминокислоты на нуклеофильный остаток другой молекулы аминокислоты. Если в реакцию вступают множество молекул ее называют реакцией поликонденсации. Рассмотрим реакцию конденсации ε-аминокапроновой кислоты.
NH2- CH2 - CH2-CH2 - CH2 - CH2- CO OH + Н NH- CH2 - CH2-CH2 - CH2 - CH2- COOH →
NH2- CH2 - CH2-CH2 - CH2 - CH2- CO- NH - CH2 - CH2-CH2 - CH2 - CH2- COOH + Н2О
Если эту реакцию повторить много раз в результате получится полимер капрон
nNH2- CH2 - CH2-CH2 - CH2 - CH2- COOH →[ - NH- CH2 - CH2-CH2 - CH2 - CH2- CO-]n+ Н2О
Группа - CO- NH - называется пептидной группой, а связь между атомами углерода и азота в ней – пептидной связью. Молекулу полимера, в данном случае, можно назвать полипептидом.
Реакция поликонденсации является обратимой, проходит при нагревании в кислой среде, обратная реакция называется реакцией гидролиза.
Получение аминокислот.
1) белок → аминокислоты (процесс гидролиза, при кипячении в кислой среде);
2) из карбоновых кислот, а в принципе – из нефти (…уксусная к-та → хлоруксусная к-та → аминоуксусная к-та).
Применение аминокислот.
1) одно из основных питательных веществ в составе белков;
2) в медицине как лекарство и для питания тяжелобольных;
3) для получения полимеров и синтетических волокон (капрон, энант).
Если функциональные группы находятся далеко друг от друга, то этим все и ограничивается. Но если группы расположены близко и влияют друг на друга, появляются специфические свойства. Например, при реакции поликонденсации  -аминокислот образуется полипептидная цепь, которая имеет неразветвленное строение и состоит из чередующихся пептидных(СО-NН) и метиленовых (СН) групп. Причем, у всех полипептидов эта основа одна и та же.
-аминокислот образуется полипептидная цепь, которая имеет неразветвленное строение и состоит из чередующихся пептидных(СО-NН) и метиленовых (СН) групп. Причем, у всех полипептидов эта основа одна и та же. 
 Неподеленная пара электронов азота вступает в сопряжение с π–электронами двойной связи. В результате затрудняется вращение вокруг связи С-N. Пептидная группа приобретает жесткий характер, а полипептидная цепь в пространстве приобретает определенную форму.
Неподеленная пара электронов азота вступает в сопряжение с π–электронами двойной связи. В результате затрудняется вращение вокруг связи С-N. Пептидная группа приобретает жесткий характер, а полипептидная цепь в пространстве приобретает определенную форму.
3. Белки – органические соединения, структурной основой которых служит полипептидная цепь, состоящая из остатков природных  -аминокислот, соединенных в определенной последовательности пептидными связями. Вот эта цепь и называется первичной структурой белка. Т. е. в отличии от полимера капрона полипептидная цепь белка состоит из остатков разных аминокислот. Молекула белка может содержать и 3 разные кислоты и 15 кислот. Причем количество остатков этих кислот в молекуле тоже разное. Кроме того, порядок чередования этих аминокислот у каждого белка свой, он закодирован в ДНК. Замена хотя бы одной аминокислоты в полипептидной цепи в результате генетической мутации или по другой причине может привести к «молекулярному» заболеванию. Количество аминокислот в цепи может быть разным. От нескольких штук до сотен тысяч. Один конец цепи, на котором находится свободная аминогруппа называют N – концом, другой, на котором находится свободная COOH – С-концом. Пептидные цепи принято записывать, начиная с N-конца. Каждую аминокислоту можно обозначить тремя или одной буквой и записать, например, в виде: G-C-S-G-G-C. У некоторых белков не одна, а несколько цепей разной длины и состава. В клетке синтез белка (образование полипептидной цепи из аминокислот) протекает при участии РНК. Вне организма проконтролировать определенное чередование аминокислот в цепи очень сложно, вероятность ошибок достаточно велика. Поэтому синтез белка на сегодняшний день хотя и возможен, но технически сложен и экономически обычно не выгоден. Чаще используют для получения белка микробиологический синтез.
-аминокислот, соединенных в определенной последовательности пептидными связями. Вот эта цепь и называется первичной структурой белка. Т. е. в отличии от полимера капрона полипептидная цепь белка состоит из остатков разных аминокислот. Молекула белка может содержать и 3 разные кислоты и 15 кислот. Причем количество остатков этих кислот в молекуле тоже разное. Кроме того, порядок чередования этих аминокислот у каждого белка свой, он закодирован в ДНК. Замена хотя бы одной аминокислоты в полипептидной цепи в результате генетической мутации или по другой причине может привести к «молекулярному» заболеванию. Количество аминокислот в цепи может быть разным. От нескольких штук до сотен тысяч. Один конец цепи, на котором находится свободная аминогруппа называют N – концом, другой, на котором находится свободная COOH – С-концом. Пептидные цепи принято записывать, начиная с N-конца. Каждую аминокислоту можно обозначить тремя или одной буквой и записать, например, в виде: G-C-S-G-G-C. У некоторых белков не одна, а несколько цепей разной длины и состава. В клетке синтез белка (образование полипептидной цепи из аминокислот) протекает при участии РНК. Вне организма проконтролировать определенное чередование аминокислот в цепи очень сложно, вероятность ошибок достаточно велика. Поэтому синтез белка на сегодняшний день хотя и возможен, но технически сложен и экономически обычно не выгоден. Чаще используют для получения белка микробиологический синтез.
Разрушение первичной структуры происходит при реакции, которая является обратной для реакции поликонденсации, т.е. при реакции гидролиза. Вне организма это происходит при нагревании в водном растворе в кислой среде. Пептидные связи рвутся, и в растворе опять появляются отдельные молекулы аминокислот. В организме человека этот процесс контролируется ферментами пептидазами.
Для белков наряду с первичной структурой характерны более высокие уровни организации молекулы, которые принято называть вторичной, третичной и четвертичной структурой или просто «сложной» структурой белковой молекулы. «Сложная» структура – это форма белковой молекулы в пространстве.
 Полипептидные цепи белка сворачиваются в пространстве различным, но для каждого белка определенным образом. Мы уже говорили, что в результате взаимодействия двойной связи карбонильной группы и неподеленной пары азота пептидная цепь становиться «жесткой» и приобретает в пространстве определенную форму. Форма молекулы зависит очень сильно от наличия определенных радикалов в кислотных остатках и порядка их чередования в полипептидной цепи. Эту форму принято называть вторичной структурой белка. Вторичная структура закрепляется с помощью водородных связей между атомом кислорода одной пептидной группы и азотом другой. Основные виды вторичной структуры:
Полипептидные цепи белка сворачиваются в пространстве различным, но для каждого белка определенным образом. Мы уже говорили, что в результате взаимодействия двойной связи карбонильной группы и неподеленной пары азота пептидная цепь становиться «жесткой» и приобретает в пространстве определенную форму. Форма молекулы зависит очень сильно от наличия определенных радикалов в кислотных остатках и порядка их чередования в полипептидной цепи. Эту форму принято называть вторичной структурой белка. Вторичная структура закрепляется с помощью водородных связей между атомом кислорода одной пептидной группы и азотом другой. Основные виды вторичной структуры:  -спираль и
-спираль и  -структура (складчатая)
-структура (складчатая)
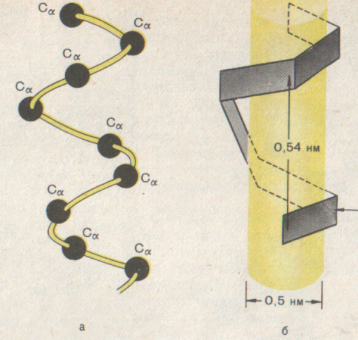
 В α-спирали полипептидный остов формируют плотные витки чередующихся пептидных групп и углерода, соединенного с радикалом. Каждый виток длиной в 0,54 нм (3,6 аминокислотных остатка) вокруг оси молекулы, все боковые радикалы находятся на наружной стороне спирали. Водородные связи направлены почти параллельно оси спирали, они удерживают цепь в закрученном состоянии.
В α-спирали полипептидный остов формируют плотные витки чередующихся пептидных групп и углерода, соединенного с радикалом. Каждый виток длиной в 0,54 нм (3,6 аминокислотных остатка) вокруг оси молекулы, все боковые радикалы находятся на наружной стороне спирали. Водородные связи направлены почти параллельно оси спирали, они удерживают цепь в закрученном состоянии.

 Если у аминокислот очень большие, или одноименно заряженные радикалы, то правильная спиралевидная структура молекулы нарушается. А β-структура образуется только тогда, когда в составе полипептидной цепи оказываются аминокислоты с небольшими боковыми радикалами, расположенными в определенной последовательности.
Если у аминокислот очень большие, или одноименно заряженные радикалы, то правильная спиралевидная структура молекулы нарушается. А β-структура образуется только тогда, когда в составе полипептидной цепи оказываются аминокислоты с небольшими боковыми радикалами, расположенными в определенной последовательности.
 В молекуле белка могут встречаться участки с разными вторичными структурами, но обычно какая-то преобладает. Например, в белках шерсти преобладают спиральные участки, а в белках шелка – складчатая структура. Полипептидные цепи могут быть сплетены друг с другом и укреплены поперечными водородными связями (коллаген).
В молекуле белка могут встречаться участки с разными вторичными структурами, но обычно какая-то преобладает. Например, в белках шерсти преобладают спиральные участки, а в белках шелка – складчатая структура. Полипептидные цепи могут быть сплетены друг с другом и укреплены поперечными водородными связями (коллаген).
Полипептидная α-спираль может сворачиваться, и тогда в пространстве молекула приобретает вид еще более компактный вид - это называется «третичная структура». Третичная структура стабилизируется не только водородными связями, но и другими видами  взаимодействия между атомами. Это ионные, дисульфидные, сложноэфирные и др. «мостики», которые образуются между радикалами аминокислотных остатков.
взаимодействия между атомами. Это ионные, дисульфидные, сложноэфирные и др. «мостики», которые образуются между радикалами аминокислотных остатков.
Обычно третичную структуру называют «глобула» - клубочек. Белки, у которых вторичная структура представляет собой конечную ступень организации молекулы (т.н. фибриллярные белки), имеют нитевидную форму и плохо растворимы в воде. Чаще всего это белки у которых преобладает складчатая первичная структура. Свертывание полипептидных цепей в глобулу и образование петель происходит из-за наличия в цепях «неспиральных» участков, состоящих из аминокислот, не допускающих образования спирали, т.е. этот процесс тоже предопределен первичной структурой белка. Форма «клубочка» может быть разной, она индивидуальна для каждого белка. При сворачивании в глобулу

 гидрофобные радикалы, как
гидрофобные радикалы, как  правило, оказываются внутри глобулы, а гидрофильные – снаружи. Это обеспечивает растворимость глобулярных белков в воде, даже при достаточно большой молекулярной массе.
правило, оказываются внутри глобулы, а гидрофильные – снаружи. Это обеспечивает растворимость глобулярных белков в воде, даже при достаточно большой молекулярной массе.
Четвертый уровень организации белковой молекулы встречается при образовании белковых комплексов из нескольких полипептидных цепей. При этом каждая цепь сохраняет свою третичную и вторичную структуру. Четвертичная структура закрепляется за счет водородных связей и гидрофобных взаимодействий между полипептидными цепями. Она характерна только для некоторых белков (гемоглобин- 4 субединицы, гексокиназа- 2 или 4, аспартаткарбомоилтрансфераза- из 12). Определяющее значение в формировании более высоких уровней организации белковых молекул имеет их первичная структура.
Биологическая активность белка определяется сложной структурой белка, т.е. четвертичной, третичной и частично вторичной структурой. Белки составляют материальную основу химической деятельности клетки. Классификация белков.
- По составу: простые и сложные (протеины и протеиды). Простые содержат только остатки аминокислот, а сложные содержат кроме аминокислот различные простетические группы (гликопротеины содержат углеводы, липопротеины – жиры, липиды, нуклеопротеины – нуклеиновые кислоты, фосфопротеины – остатки фосфорной кислоты, гемоглобин – порфирин, металлопротеины – комплексные соединения металлов).
- По функциям: структурные, транспортные, защитные, регуляторные, ферментные, сократительные и двигательные, токсины, пищевые, запасные и т.д. Структурные белки образуют волокна, навитые друг на друга либо уложенные плоским слоем. Они выполняют опорную или защитную функции, скрепляя биологические структуры и придавая им прочность. Наиболее важными в этой группе являются фибриллярные белки коллагены, составляющие основу хрящей, сухожилий, кожи. Волосы и ногти состоят в основном из нерастворимого белка кератина, связки содержат белок эластин, способный растягиваться в двух направлениях. Сократительные белки дают возможность клеткам и организму способность сокращаться, изменять форму, передвигаться. Так актин и миозин составляют основу скелетных мышц, тубулин обеспечивает подвижность ресничек. Защитные белки (антитела) распознают проникшие в организм чужеродные белки (вирусы, микроорганизмы) и, образуя с ними комплекс, антиген-антитело нейтрализуют их. Тромбин и фибриноген – белки свертывающей системы крови защищают организм от кровопотери при повреждении сосудов. Транспортные белки образуют комплексы с определенными молекулами и ионами и переносят их по организму (гемоглобин- кислород, липопротеины- липиды, альбумины- микроэлементы, витамины, гормоны). В клеточных мембранах имеются специфические белки-переносчики, транспортирующие в клетку и обратно глюкозу. Более подробно функции белка изучаются в курсе биологии.
 Среди веществ белковой природы сейчас принято выделять в особую группу пептиды. У них более низкая молекулярная масса (потому что число аминокислотных остатков в полипептидной цепи невелико) и более разнообразный аминокислотный состав. Некоторые пептиды проявляют антибактериальное действие и используются как лекарственные средства. Например: грамицидин S – циклический декапептид, оказывающий антибактериальное действие на стрептококки и пневмококки. Практически все пептиды выполняют в организме регуляторную функцию (глутатион, вазопрессин, окситоцин).
Среди веществ белковой природы сейчас принято выделять в особую группу пептиды. У них более низкая молекулярная масса (потому что число аминокислотных остатков в полипептидной цепи невелико) и более разнообразный аминокислотный состав. Некоторые пептиды проявляют антибактериальное действие и используются как лекарственные средства. Например: грамицидин S – циклический декапептид, оказывающий антибактериальное действие на стрептококки и пневмококки. Практически все пептиды выполняют в организме регуляторную функцию (глутатион, вазопрессин, окситоцин).
Физические свойства. Белки – твердые вещества (очень большая молекулярная масса), без цвета, запаха и вкуса. Не плавятся, при повышении температуры в отсутствии воздуха начинают разлагаться. Растворимость белков в воде зависит от молекулярной массы и сложной структуры белка.