Гетерогенными называются такие системы, которые состоят из нескольких фаз и имеют реальную физическую границу раздела. Фаза – это часть системы с одинаковыми химическими и физико-химическими свойствами. Межфазные процессы заканчиваются установлением гетерогенных динамических равновесий. Например, минеральные компоненты костной и зубной ткани, основу которых составляет гидроксофосфат кальция Са5(РО4)3ОН, находятся в состоянии химического равновесия с ионами кальция и фосфата плазмы крови. Смещение этого равновесия под влиянием разнообразных факторов может привести к развитию патологических состояний.
В аналитической химии существует ряд гетерогенных процессов, которые сопровождаются выпадением или растворением осадков. Знание общих закономерностей установления и смещения гетерогенного равновесия в системе осадок ↔ раствор позволяет управлять процессами разделения, растворения и определения веществ.
Константа растворимости (ПР). Рассмотрим процессы, возникающие при взаимодействии малорастворимого, но сильного электролита BaSO4 с водой. Под действием диполей воды ионы Ва2+ и SО42– из кристаллической решетки будут переходить в жидкую фазу. Одновременно с этим процессом под влиянием электростатического поля кристаллической решетки часть ионов Ва2+ и SО42– вновь будет осаждаться. При данной температуре в гетерогенной системе, наконец, установится равновесие: скорость процесса растворения (v1) будет равна скорости процесса осаждения (v2), т.е. v1= v2:
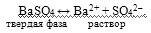
Раствор, находящийся в равновесии с твердой фазой BaSO4, называется насыщенным относительно сульфата бария. Насыщенный раствор представляет собой равновесную гетерогенную систему, которая характеризуется константой химического равновесия:

где: а(Ва2+) – активность ионов бария;
а(SO42–) – активность сульфат-ионов;
a(BaSO4) – активность сульфата бария.
Знаменатель этой дроби – активность кристаллического BaSO4 – является постоянной величиной, равной единице. Произведение двух констант дает новую постоянную величину, которую называют термодинамической константной растворимости и обозначают Ks0:
Ks0 = а(Ва2+)∙а(SO42–).
Эту величину раньше называли произведением растворимости и обозначали ПР. Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение равновесных активностей его ионов есть величина постоянная при данной температуре.
Если принять, что в насыщенном растворе малорастворимого электролита коэффициент активности f ≈ 1, то активность ионов в таком случае можно заменить их концентрациям, так как а(Х) = f(X) ∙ С(Х). Термодинамическая константа растворимости Ks0 перейдет в концентрационную константу растворимости Ks: Ks= С(Ва2+) ∙ С(SO42–),
где С(Ва2+) и С(SO42–) – равновесные концентрации ионов Ва2+ и SO42– (моль/л) в насыщенном растворе малорастворимого сильного электролита сульфата бария. Для упрощения расчетов обычно пользуются концентрационной константой растворимости Ks, принимая f(X) = 1.
Если малорастворимый сильный электролит образует при диссоциации несколько ионов, то в выражение Ks (или Ks0) входят соответствующие степени, равные стехиометрическим коэффициентам:

В общем виде значение концентрационной константы растворимости для электролита АтВп имеет вид
K3=Cm(An+)×Cn(Bm–).
Величиной Ks принято пользоваться только в отношении электролитов, растворимость которых в воде не превышает 0,01 моль/л.