1Градуировочный график строят по результатам измерения Е в не-скольких градуировочных растворах, приготовленных с добавлением того же фонового электролита, что и анализируемый раствор. На оси ординат откладывают значение Е, а по оси абсцисс – р С. Градуировочный график представляет прямую линию. Затем измеряют значе- ние Е в анализируемом растворе и по графику находят соответствую- щее ему значение р С. Концентрацию определяемого иона в пробе (ci, мг/кг) находят по формуле: сi=CVM*103/m?
где С – концентрация определяемого иона в анализируемом растворе (С = 10-рС), моль/дм3; V – объем анализируемого раствора, 50 см3; M – молярная масса определяемого иона, г/моль; m – масса навески, взя-той для анализа, г; 103 – коэффициент пересчета с массы пробы на 1 кг продукта.
2. Метод стандартных добавок. В анализируемом растворе определенного объема измеряют зна чение Е 1. Далее в анализируемый раствор вводят добавку стандартного раствора, содержащего известное количество определяемого иона, и регистрируют значение Е 2. Расчет концентрации определяемого иона (С, моль/дм3) в анализируемом растворе проводят по формуле
Применение:
Вода питьевая: определение жесткости, CL-,NO3-, F
Медицина: Na+K+Ca2+CL-
Пищевая промышленность: Na+ K+Ca2+ Cl-
Cельское хозяйство: Na+ K+Ca2+ Cl- и другие.
Инверсионная вольтамперометрия. Сущность метода. Характеристика вольтамперограммы. Характеристика применяемых средств измерения и испытательного оборудования. Качественный и количественный анализ. Основные этапы. Применение метода для контроля качества продукции.
Инверс. В-ия(ИВ) Наиболее эффективным способом повышения чувствительности метода вольтамперометрии – является предварительное концентрирование определяемого компо-нента на поверхности индикаторного электрода с последующим элек-трохимическим растворением концентрата и регистрацией величины тока электрорастворения. Поскольку концентрация определяемого компонента в концентрате на несколько порядков выше, чем в раство-ре, то величина регистрируемого тока тоже возрастает. Такой способ регистрации вольтамперограммы, позволяющий снизить нижнюю границу определяемых концентраций для органических веществ до 10-10–10-9, а для неорганических веществ до 10-11 моль/ дм3, и лежит в основе метода инверсионной вольтамперометрии.
Регистрация аналитического сигнала в инверсионной вольтамперометрии включает четыре стадии: 1. Подготовка электродов; 2. Концентрирование (накопление) определяемого элемента на поверхности рабочего электрода при заданном потенциале электрода; 3. Регистрация тока растворения концентрата определяемого элемента при изменении потенциала рабочего электрода;
4. Расшифровка полученной зависимости тока от потенциала.
В инверсионной вольтамперометрии используют стационарные электроды – висящая ртутная капля или любой неподвижный твердый микроэлектрод. Так как вся вольтамперная зависимость в этом случае регистрируется на одной и той же электродной поверхности перед ре-гистрацией каждой вольтамперограммы необходимо проводить очистку электродов.
В зависимости от способа накопления на электроде определяемо-го вещества различают следующие варианты инверсионной вольтам-перометрии:
– анодная. Катион металла электролитически восстанавливают до металла с образованием амальгамы на ртутном электроде или пленки металла на поверхности твердого электрода. Выделенный металл анодно растворяют (окисляют). При реализации данного способа накопления наблюдаются наименьшие пределы обнаружения.
– катодная. Определяемое вещество концентрируют на поверх-ности ртутного электрода в виде осадка с ионами ртути, образующи-мися при потенциале анодного растворения ртутного электрода, а осадок затем катодно растворяют.
– адсорбционная. Соединения, обладающие поверхностно-активными свойствами (органические вещества или комплексы ме-таллов с органическими реагентами), концентрируют на поверхности индикаторного электрода за счет адсорбции и затем электрохимиче-ски восстанавливают или окисляют.
Расшифровать вольтамперограмму – значит выделить на вольт-амперограмме пик тока, который может служить аналитическим сиг-налом, т.е. может охарактеризовать природу определяемого элемента и его концентрацию в растворе. Вольтамперограмма содержит один пик, если на рабочем электроде концентрируют один элемент. Если подобраны условия одновременного накопления на рабочем электроде нескольких элементов, то вольтамперограмма может содержать два, три, четыре пика, соответствующие последовательному электрорас-творению концентратов определяемых элементов. Выделение пика то-ка на вольтамперограмме осуществляется с помощью соответствую-щего программного обеспечения
Анализатор вольтамперометрический АВА-3
Электрохимический прибор реализующий метод ИВ на твердом вращающем электроде из углеродного материала. Предназначен для измерения микроконцентраций токсичных элементов в воздухе, воде, пищевые продукты
Анализатор вольтамперометрический ИВА-5
Предназначен для определения концентрации ионов меди, свинца, цинка, олова; в природных питьевых водах, пищевых продуктах. Область применения -пищевая промышленность, медицина, сельское хозяйство.
Применение:
Определяемые ионы (Cu2+ Zn2+ Pb2+) определение аскорбиновой кислоты, ацетона, меди.
С помощью метода ИВ решают проблему определения следов тяжелых металлов в водах и биологических материалах.
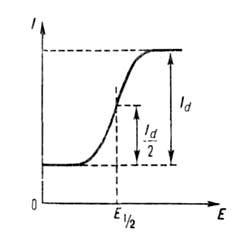
Информацию о количестве вещества (рис.10) несет высота полягрофической волны. Информацию о природе восстанавливающего иона несет положение поляграфической волны на оси потенциалов..Потенциал полуволны является качественной характеристикой иона в растворе данного фонового электролита
Потенциометрическое титрование. Сущность. Реакции титрования. Виды и правила построения кривых титрования. Характеристика применяемых средств измерения и испытательного оборудования. Характеристика метода и применение метода для контроля качества продукции.
В потенциометрическом титровании (ПТ) регистрируют изменение потенциала индикаторного электрода в процессе титрования исследуемого раствора стандартным раствором реагента в зависимости от объема последнего. ПТ проводят с использованием различных реакций: кислотно-основного и окислительно-восстановительных взаимодействий, осаждения и комплексообразования.
При ПТ в исследуемый раствор, помещённый в потенциометрическую ячейку, опускают индикаторный электрод, возникновение потенциала на котором обусловливается или непосредственно определяемым веществом (если оно электроактивно), или косвенно (если оно неэлектроактивно) в результате его химического взаимодействия с другим потенциалопределяющим компонентом. Конечную точку титрования (КТТ) определяют по скачку потенциала, вызванного заменой одной электрохимической реакции другой до и после КТТ с соответствующим изменением величины потенциала.
При кислотно-основном потенциометрическом титровании изменение активности ионов водорода в растворе определяется по изменению потенциала любого электрода, применяемого для измерения величины рН. Наиболее удобной парой являются стеклянный и каломельный электроды. Стеклянный электрод до и после измерений калибруют по двум (или более) буферным растворам с точно известными значениями рН. Для обеспечения стабильных показаний рН-метра необходимы стабилизация напряжения на входе в прибор, а также заземление корпуса прибора и металлической оплетки коаксиального кабеля стеклянного электрода
. При титровании по осаждению (например, титрование ионов галогена) в качестве индикаторного используют серебряный электрод. При титровании смеси анионов галогенов вследствие различной растворимости галогенидов серебра на кривой титрования будет несколько перегибов.
При окислительно-восстановительном титровании индикаторным электродом служит гладкий платиновый электрод.При потенциометрическом титровании в неводных средах используют те же индикаторные электроды, что и в водных растворах.
Преимущества ПТ: 1.Исключение субъективных ошибок;2. Возможность анализа мутных и окрашенных растворов;3. Документальность;4.Легкая автоматизация;5.Возможность дифференцированного титрования компонентов смеси.
Рис. 1.2. Кривые потенциометрического титрования. а) интегральная кривая; б) дифференциальная кривая;в) кривая титрования по второй производной; г) кривая Грана.
Кривые титрования могут быть построены в координатах: потенциал индикаторного электрода (Е) объем титранта (V) (рис. 1.2а.). Это так называемая интегральная кривая потенциометрического титрования. Точка перегиба на кривой отвечает точке эквивалентности. Ее находят графическим путем: нахождением середины отрезка между касательными двух ветвей кривой.
Для более точного нахождения точки эквивалентности часто строят дифференциальную кривую потенциометрического титрования в координатах ∆Е / ∆V V (рис. 1.2б). На точку эквивалентности указывает максимум полученной кривой, а отсчет по оси абсцисс, соответствующий этому максимуму, дает объем титранта, израсходованного на титрование до точки эквивалентности.
На рис. 1.2впредставлена кривая потенциометрического титрования в координатах: вторая производная потенциала по объему титранта ∆2Е / ∆2V объем титранта, V. Для нахождения точки эквивалентности соединяют концы обеих ветвей кривой. В методе Грана (рис. 1.2г) точка эквивалентности определяется по графику в координатах: ∆V / ∆E V. Перед точкой эквивалентности и после нее кривая Грана линейна. Точка эквивалентности находится как точка пересечения этих прямых.
Достоинства и удобства метода Грана особенно заметны при анализе разбавленных растворов, позволяющих определить точку эквивалентности с достаточной точностью вследствие линейности графика, а также в тех случаях, когда кривая титрования выражена плохо. В потенциометрическом титровании могут быть использованы любые известные типы химических реакций, протекающие быстро и количественно.
потенциометрическое титрование – для определения кислотности молока и молочных продуктов,в том числе для детского питания, продуктов переработки плодов и овощей, консервов и пресервов из рыбы. В металлургической промышленности преимущественно используется потенциометрическое титрование для определения углерода, марганца, мышьяка, кобальта, бора, хрома и др. в чугунах, сталях, сплавах, рудах.
ВА методы. Сущность. Характеристика ЭХ процессов. Классификация ВА методов. ВА кривые: виды и характеристика. Регистрация ВА кривых: условия и средства измерений. Применение фоновых электролитов и их виды. Хар-стика и правила работы с эл-дами.
Вольтамперометрия – это группа методов, основанных на изучении вольтамперных (поляризационных) кривых (вольтамперограмм) – зависимостей силы тока в электролитической ячейке от величины потенциала, приложенного к индикаторному элек-троду, который погружен в анализируемый раствор. На электроды налагают напряжение, изменяющее во времени – развертка напряжения. Величину этого напряжения (потенциал рабочего электрода, измеренный относительно электрода сравнения) откладывают по оси абс-цисс, обычно направленной в сторону отрицательных потенциалов. Вдоль оси ординат откладывают силу тока, причем катодные токи соот-ветствуют верхней, а анодные – нижней половине оси ординат (рис. 9).
Когда рабочий электрод является неполяризуемым, а электрод сравнения всегда неполяризуемый, потенциалы электродов не изме-няются. Поэтому при увеличении напряжения на электродах сила то-ка, связанная с напряжением через закон Ома, тоже будет возрастать, а вольтамперограмма будет представлять прямолинейную зависи-мость (кривая 1, рис. 9). В случае поляризуемого индикаторного элек-трода – несмотря на приложенное напряжение, в области определен-ных потенциалов через ячейку ток практически не протекает (кривая 2, рис. 9).
Аналитический интерес представляют вольтамперограммы, полу-ченные в присутствии веществ, способных восстанавливаться или окисляться на индикаторном электроде в области исследуемых напряжений – области его поляризации. Подаваемое на электрод напряжение изменяется во времени, как правило, линейно, и по до-стижении потенциала восстановления, определяемые ионы начинают разряжаться на электроде. В результате данного процесса сила тока в цепи начинает возрастать(рис 10)

рис 1
Информацию о количестве вещества (рис.10) несет высота полягрофической волны, т.е сила предельно диффузионного тока Id(рис.10). Величина диффузионного тока прямо пропарциональна концентрации определяемого вещества.
Id=k*c где к-коэф. пропарциональности между концентрацией вещества и силой диффузионного тока.
Информацию о природе восстанавливающего иона несет положение поляграфической волны на оси потенциалов. Потенциал, при котором сила тока равна половине предельно диффузионного (I=1/2 Id) называется полуволны – Е1/2.Потенциал полуволны является качественной характеристикой иона в растворе данного фонового электролита
Методы.:
- полярографию. -в качестве рабочего электрода используется ртутный капающий. Его преимуществом является постоянное возобновление поверхности.
- импульсную полярографию(аналитическим сигналом служит ток, измеренный непосредственно перед отрывом капли и вольтамперограмма имеет классический вид),
- инверсионную вольтамперометрию, происходит за счет предварительного концентрирование определяемого компонента на поверхности индикаторного электрода с последующим расворением концентрата и регистрация вел.тока
- амперометрию- измерение силы тока при пост.значении потенциала.
- Вольтаметрию- основана на изучении вольтамперных кривых зависимостей силы тока от напряжения
Для проведения анализа вольтамперометрическими методами используюся приборы полярографы и вольтамперометрические анализаторы. Большинство анализаторов работают под управление компьтера с пом.спкц.программ.Подготовка ср-в измерения к анализу осуществляется в соответ.с инструкции по зксплуатации.
Важной стадией вольтамперометрического анализа является подготовка пробы, заключающая в приготовлении анализируемого р-ра,осн.элементами кот.явл.зола и фоновый электролит. Использование минерализации пробы значительно усложняет анализ. Однако временные затраны на подготовку пробы м.б.сокращены за счет проведения ее последних этапов непосредственно в анализатор в автоматическом режиме.
Фон-ый эл-т должен характеризоваться значительно более отрицательным потенциалом выделения, чем у анализируемого иона и присутствовать в анализируемом р-ре в достаточнойконц.
Операции при выполнении измерений и обработки рез-ов ан-за,в первую очередь это зависит от выбранного метода определения конц.ан-за
Важным достоинством методов вольтамперометрии является воз- можность одновременного определения двух и более компонентов из одного раствора. В этом случае на вольтамперограмме будет наблю- даться не одна, а несколько волн – по числу восстанавливающихся ионов, а возможно и больше, так как при ступенчатом восстановлении один ион может давать две волны. По величине потенциала полувол- ны определяют качественный состав раствора, а по силе диффузион- ного тока – концентрацию каждого из определяемых компонентов.
21. Полярография – разновидность волътамперометрии с использованием индикаторного микроэлектрода из жидкого металла, пов-сть к-рого периодически или непрерывно обновляется. При этом не происходит длительного накопления продуктов электролиза на пов-сти раздела электрод-раствор в электролитич. ячейке. Индикаторным электродом в полярографии служит чаще всего ртутный капающий электрод. Исполь-зуют также капающие электроды из жидких амальгам и расплавов, струйчатые электроды из жидких металлов, многокапельные электроды, в к-рых жидкий металл или расплав продавливают через диски из пористого стекла, и др.
В соответствии с рекомендациями ИЮПАК различают неск. вариантов полярографии: постояннотоковая полярография (исследует зависимость тока I от потенциала Е индикаторного микроэлектрода), осциллополярография (зависимость dE/dt от t при заданном I(t), где t -время), полярография с разверткой I (зависимость Е от I), разностная полярография (зависимость разности токов в двух ячейках от Е), полярография с однократной или многократной разверткой Е за время жизни каждой капли, циклическая полярография с треугольной разверткой Е, полярография со ступенчатой разверткой Е, разл. виды переменнотоковой и импульсной полярографии и др.
На полярограммах, регистрируемых в полярографии при использовании капающих индикаторных электродов, наблюдаются осцилляции I, пропорциональные величине I. Эти осцилляции связаны с постепенным увеличением пов-сти капли и ее периодич. обрывами.
Полярографическая установка:
• Резервуар с ртутью, соединенный шлангом с капилляром, погруженным в анализируемый раствор;
• Электрод сравнения – слой донной ртути; каломельный или хлоридсеребрянный электроды.
Качественный анализ: 1. Потенциал при I = ½ Id → E1/2. 2. [Ox]= [Red]
3. E = E0 + (0,059/z)lg [Ox]/[Red] 4. E1/2 = E0
Причины отличия потенциала полуволны от стандартного электродного потенциала: -Кинетические явления – замедленное протекание или сложность механизма перехода вещества через границу раздела фаз;
-Адсорбционные явления – разная скорость восстановления свободных и адсорбированных частиц; -Влияние сопутствующих химических реакций.
Количественный анализ: Уравнение Ильковича: I=0.620ZFAD2/3W1/2U1/6C
z – число электронов в электродной реакции; F – постоянная Фарадея, Кл/моль; D – коэффициент диффузии иона, см2·с-1; m – скорость истечения ртути из капилляра, мг·с-1; t – период капания ртути, с; с – концентрация иона в растворе, моль/л; c0 - концентрация иона в приэлектродном слое, моль/л.
Классическая полярография. Достоинства:1. Применение капающего ртутного электрода – постоянное возобновление поверхности; 2. Широкие возможности для определения ионов, восстанавливающихся в катодной области – до (-2) В.
Недостатки: 1. Ограничение рабочего диапазона ртутного капающего электрода в анодной области - до (+0,2) В;
2. Значительная величина емкостного тока

Улучшение соотношения IF/IC(фарадеевского и ёмкостного токов)
1. Увеличение IF;2. Уменьшение IC;3. Разделение IF и IC.
Решение – иной способ развертки потенциала и иной способ измерения потенциала:
• Осциллографическая полярография и инверсионная вольтамперометрия
• Импульсная и квадратно-волновая переменнотоковая полярография
• Синусоидальная переменнотоковая полярография.
Осциллографическаяполярография
• На электрод подают постоянное напряжение с высокой скоростью –0,1- -1 В/с;
• Полярограмма регистрируется за время жизни одной капли;
• 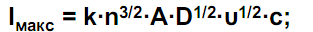
Импульсная полярография:
1.Нормальная прямоугольная импульсная полярография::
• Измерение тока – в конце жизни капли;
• На электрод налагают импульсы (t ~50мс) постоянного напряжения прямоугольной формы, возрастающие по величине;
• В промежутках между импульсами потенциал электрода поддерживают таким, чтобы IF был мал;
• Ток измеряют непосредственно перед отрывом капли.
2.Дифференциальная прямоугольная импульсная полярография:
• На линейно увеличивающееся напряжение (5 мВ/с) подают одинаковые короткие импульсы
(Е = 20-100 мВ, t ~20 мс);
• Измерение тока – до подачи импульса и вконце импульса;
22. Амперометрия. Сущность – измерение силы тока при постоянном значении потенциала.В качестве рабочих электродов обычно применяются вращающиеся платиновые, графитовые и другие твердые электроды.
Подобно другим электрохимическим методам, различают прямую амперометрию и амперометрическое титрование. Важное практиче-ское значение прямой амперометрии – ее использование в электрохи-мических сенсорах. Наиболее известными примерами являются дат-чик Кларка для определения кислорода и ферментативный датчик для определения глюкозы в крови. Электрохимические ячейки, работаю-щие по принципу амперометрии, используются в качестве датчиков в жидкостной хроматографии.
В процессе амперометрического титрования после прибавления отдельных порций реактива отмечают силу тока при напряжении, со-ответствующем величине предельного тока. По этим данным строят кривую амперометрического титрования в координатах сила тока – объем титранта и графически находят точку эквивалентности.
Вид кривой амперометрического титрования зависит от того, какой компонент реакции титрования вступает в электродную ре-акцию – определяемое вещество, титрант или продукт реакции.
Электрохимическиактивным является 1)титрант
2)– определяемое вещество
3)– продукт реакции
| I 1) I 2) I 3) Т.Э. Т.Э. Т.Э V V V |
В методах амперометрического титрования используются реак-ции осаждения, комплексообразования и окисления-восстановления, а при определенных условиях – существенном различии произведений растворимости или окислительно-восстановительных потенциалов – возможно последовательное определение нескольких аналитов без предварительного разделения.
Характеризуется: высокой точностью; чувствительный; проще чем некоторые методы; экспрессность; возможность анализировать разбавленные растворы, мутные и окрашенные. Аппаратурное оформление установок амперометрического титрования несложно, особенно просты установки для титрования с двумя индикаторными электродами.
Широкое распространение получил метод амперометрического титрования с двумя индикаторными (поляризуемыми) электродами. Введение титранта вызывает появление в анализируе-мом растворе двух окислительно-восстановительных пар, причем до точки эквивалентности в растворе в заметных количествах будут находится компоненты пары, образованной титруемым веществом, а после точки эквивалентности компоненты, образованные титрантом.
Применение:
• Хром в электролитах;
• Кадмий в металлическом цинке;
• Свинец, медь в различных
промышленных объектах, в том числе сточных водах;
• Тиомочевина в техническом продукте.
• Амилоза в крахмале;
• Аскорбиновая кислота в напитках и соках;
• Ацетон уксусной кислоте;
• Редуцирующих сахаров в вине;
• Медь в вине;
• Сульфгидрильные группы белка в тесте, мясе.
Кулонометрия (К) и кулонометрическое титрование (КТ). Сущность методов. Основные этапы анализа. Характеристика оборудования и методов. Применение для контроля качества продукции.
Кулонометрия- метод анализа, основанный на измерении количества электричества (Q), прошедшего через электролизер при электрохимическом окислении или восстановлении вещества на рабочем электроде.В основе методов – законы Фарадея: 1) кол-во восстан-го или окисленного в-ва в процессе электролиза прямо пропорционально кол-ву прошедшего электричества; 2) массы различных в-в, выделенных или растворенных при прохождении одного и того же кол-ва электричества, пропорционально их электрохимическим эквивалентам.
Электрохимический эквивалент – это масса в-ва, выделившегося на электроде (или растворившегося с электрода) в процессе электролиза при протекании единицы кол-ва электричества, т.е 1 Кл.
Условия проведения методов – наличие надежного способа измерения кол-ва электричества и способа установления конца реакции; в анализируемом растворе д. протекать только одна электрохим реакция; побочные реакции д. отсутствовать.
 Если электрохимический процесс протекает при постоянной силе тока I (гальваностатичесая К), то кол-во электричества Q за время электролиза tэ: Q=Itэ. Если ток во времени измен-ся (прямая потенциостатическая К), то Q=
Если электрохимический процесс протекает при постоянной силе тока I (гальваностатичесая К), то кол-во электричества Q за время электролиза tэ: Q=Itэ. Если ток во времени измен-ся (прямая потенциостатическая К), то Q=  и кол-во электричества равно площади под кривой. Этот метод прост, но недостаточно точен для колич-го анализа.
и кол-во электричества равно площади под кривой. Этот метод прост, но недостаточно точен для колич-го анализа.
Для повышения точности используют кулонометры – электролитические ячейки, в которых при замыкании цепи протекает электрохим. р-ция известной стехиометрии со 100%-м выходом по току (нет конкурирующих р-ций).
Измерив массу в-ва, образовавшегося в кулонометре после электролиза, можно по формуле Фарадея рассчитать кол-во электричества: Q=mnF/M, где Q – кол-во электричества, необходимое для выделения на электроде m граммов в-ва с молярной массой эквивалента равной M/n; n – число электронов, участвующих в электродной реакции; М – молярная масса определяемого в-ва.
Принцип работы наиболее известных кулонометров:
Серебряный кулонометр. Электролитическая ячейка состоит из Pt-го катода и Ag-го анода, погруженных в раствор нитрата серебра. При прохождении тока на катоде осаждается металлическое серебро (Ag++e→Agтв). Осадок хрупкий, поэтому катод находится в стеклянном тигле. Тигель вместе с электродом сушат до пост-й массы перед и после электролиза, взвешивают, по разности масс находят массу осадка серебра и рассчитывают по закону Фарадея количество электричества.
Медный кулонометр. Электролитическая ячейка состоит из Pt-го катода и Pt-го анода, погруженных в подкисленный серной кислотой раствор сульфата меди. При прохождении тока на катоде выделяется осадок металлической меди (Cu+2+2e→CuТВ). Катод взвешивают до и после электролиза и рассчитывают количество электричества.
Кулонометр. титр-е В анализируемый раствор вводят электрохимически активный вспомогательный реагент, из ко-торого электролитически генерируют титрант (кулонометрический титрант), и он количественно химически взаимодействует с опреде-ляемым веществом. Содержание определяемого компонента оценива-ют по количеству электричества, прошедшего через раствор при гене-рировании титранта вплоть до момента завершения химической реак-ции, который устанавливают, одним из доступных способов.
кулонометрическое титрование при постоянном токе. Титрант выбирают таким образом, чтобы он взаимодействовал с определяемым веществом быстро и стехиометрически, по достижении точки эквивалентности процесс титрования немедленно прекращают. Кулонометрические ме-тоды отличаются от других видов титрования только способом добав-ления титранта в исследуемый раствор.
Преимущества кулонометрического метода: -простота количественных расчетов – по продолжительности электролиза; -не требуется построение калибровочных зависимостей; -нет необходимости в стандартных растворах; -легко автоматизируется; -косвенная кулонометрия (титрование) позволяет использовать в качестве титрантов растворы, неустойчивые на воздухе.
Применение потенциостатической кулонометрии – определение сурьмы, мышьяка, висмута, кадмия, меди и др.; определение нескольких элементов при совместном присутствии.
Применение КТ – определение кислот, оснований, галагенидов, S2O32-, As3+, Fe2+, фенолы, Cr6+ и др.Кулонометрическим м/дом определяют электронеактивные вещества, н-р галагениды осаждаются ионами Ag+, которые генерируются на Ag-электроде; ряд органических веществ – пикриновую и аспарагиновую кислоты, хлорбензолы и фенолы, азокрасители и т.д. Метод используют в металлографическом анализе, для исследования кинетики реакций, изучения коррозий и др.
Кондуктометрия и кондуктометрическое титрование. Сущность. Основные этапы анализа. Характеристика оборудования и методов. Применение для контроля качества продукции.
Сущность метода. Кондуктометрия – метод количественного анализа, основанный на измерении электропроводности растворов. В кондуктометрии оперируют двумя величинами: удельной электропро- водностью (κ) и эквивалентной электропроводностью (λ). Удельной электропроводностью называется электропроводность электрического проводника площадью сечения 1 м2 и длиной 1 м. Ед. измерения является См/м, Эквивалентной электропроводностью называется удельная элек- тропроводность раствора электролита концентрацией 1 моль экв./м3: λ=К/С,где С – конце-ция электролита, моль экв./м3; κ – удельная электро- проводность, См/м.
В основе кондуктометрии лежат следующие законы: 1. В предельно разбавленных растворах эквивалентная электро- проводность (λ0) является постоянной характеристикой раствора, не зависящей от изменения концентрации электролита. Это означает, что в разбавленных растворах электропроводность прямо пропорциональ- на количеству заряженных частиц – ионов. 2. Предельная эквивалентная электропроводность раствора сильного электролита (λ0) равна сумме эквивалентных электропроводностей ионов: λ0=λ0++λ0−, 4. Температура анализируемого раствора оказывает существенное влияние на измеряемые величины удельной электропроводности. Все кондуктометрические измерения рекомендуется проводить в термо- статированной ячейке.
Прямая кондуктометрия – непосредственное определение концентрации электролита путем измерения электропроводности раствора электролита с известным качественным составом. Кондуктометрическое титрование – анализ, основанный на определении содержания вещества по излому кривой титрования (зависимость χот VT). Излом получается вследствие резкого изменения электропроводности при взаимодействии определяемого вещества с титрантом. Прямая кондуктометрия имеет ограниченное применение, причиной чего является то, что электропроводность является величиной аддитивной и зависит от содержания в растворе всех ионов разной природы. Прямые кондуктометрические измерения используют для контроля качества дистиллированной и деминерализованной воды. Этот контроль осуществляется кондуктометрами – приборами для измерения удельной электропроводности. Прямое измерение удельной электропроводности подвижной фазы, выходящей из колонки с помощью кондуктометра, - способ детектирования в ионной хроматографии. Для кондуктометрического титрования пригодны кислотно-основные реакции и реакции осаждения, сопровождающиеся заметным изменением электропроводности вследствие образования малодиссоциирующих или малорастворимых соединений. Методы КТ бывают постояннотоковые и переменнотоковые, последнии могут быть низкочастотными(частота тока меньше 105 Гц) или высокочастотными (больше 105 Гц). Различают контактную и бесконтактную кулонометрию в зависимости от отсутствия или наличия контакта межу электролитом и входными цепями измерительного прибора. Наиболее распространенные контактный низкочастотный и бесконтактный высокочастотный методы. К достоинствам метода кондуктометрического титрования относится возможность проводить измерения с высокой точностью даже в очень разбавленных растворах, окрашенных Кондуктометрию применяют для осуществления непрерывного ХАК производства, определения концентрации солевых растворов, содержания солей в воде, определения следов воды в неводных растворителях, газах, твердых солях, целлюлозе, бумаге, зерне и т. д. Кондуктометрию применяют для определения различных газов (СО2, СО, О2, NH3, H2S и др.), содержания вредных примесей в воздухе, воде, пищевых продуктах, для контроля качества молока, вин, соков. Кондуктометрическое титрование используется для анализа фармацевтических препаратов. В этом методе чаще всего используют следующие реакции: -нейтрализации; -осаждения; -комплексообразования; -ОВ. Для проведения кондуктометрического титрования необходимо точно измерять сопротивление (проводимость) раствора электролита. Достоинства: высокая чувствительность, точный метод, простота методик, доступность аппаратуры, возможность автоматизации анализа.
25. Аналитическая служба Приборное, нормативно-техническое и методическое обеспечение аналитической службы. Требования к аналитику.
Аналитическая служба– это вид сервиса или система обеспечения потребностей общества в лабораторно-инструментальных исследованиях и испытаниях различной продукции. К аналитическим службам предприятия относятся подразделения (лаборатории, отделы технического контроля и т.д.), осуществляющие внелабораторный и лабораторный контроль качества и безопасности сырья и продукции, параметров производственного процесса и окружающей среды.
Для эффективного выполнения вышеобозначеных функций производственные лаборатории должны быть обеспечены необходимыми ресурсами:
– приборной базой – испытательным оборудованием и средствами измерения;
– нормативно-технической и методической базой – техническими нормативно-правовыми актами, регламентирующими требования к лаборатории, объектам контроля и порядку проведения испытаний, методиками выполнения измерений, технической документацией на оборудование, документами системы менеджмента качества, организационно-методической документацией;
– кадрами – инженерами, химиками, лаборантами в достаточном, согласно объему выполняемых работ, количестве и соответствующей перечню выполняемых работ квалификации.
Правила работы в аналитических лабораториях регламентируются отраслевыми и государственными техническими нормативными правовыми актами и зависят от вида производства, размещения аналитической службы, применяемого испытательного оборудования и средств измерений.
Аналитическая служба - совокупность аналитических служб отдельных ведомств. Существенные аспекты работы аналитической службы:
автоматизация анализа; стоимость анализа; неопределенность результатов; аппаратурное и нормативно-методическое обеспечение.
Размещение и оснащение в соответствии с требованиями ТНПА;
Персонал соответствующей квалификации в достаточном количестве (например, сменные химики, микробиологи, лаборанты);
Работа в соответствии с программами (схемами) производственного контроля.
Приборное обеспечение
Аналитические приборы становятся все более совершенными, дают все более надежные результаты, обеспечивают принципиально новые возможности анализа, например, большую чувствительность, многокомпонентность, исследование распределения компонентов в образце, дистанционный анализ, удобство работы и т.д.
При осуществлении приборного обеспечения возникает ряд вопросов:
Что лучше - купить отдельный прибор или целый комплекс, включающий, кроме собственно измерительного прибора, еще и программное обеспечение, дополнительные приспособления, расходные материалы, запуск и ремонт?
Что предпочтительнее - приобрести отечественный прибор, может быть, обладающий не самыми лучшими характеристиками, зато намного более дешевый, или надежный, но дорогой импортный, а потом зависеть от фирмы-продавца, пытаясь приобрести запасные части и расходные материалы, а то и методики?
Покупать ли всем (в регионе или в отрасли), например, вольтамперометрические анализаторы одной фирмы (чтобы проще было приборы обслуживать, использовать одни и те же методики, обмениваться опытом эксплуатации и запасными частями) или разрешить закупку разных приборов, из разных стран и сравнивать, какие лучше?