Справочный материал по Физиологии.
Глава 7 – Физиология сократительных элементов.
Двигательные функции, осуществляемые сократительными элементами мышечных тканей (поперечнополосатое скелетное МВ, кардиомиоциты, ГМК) и немышечными контрактильными клетками (миоэпителиальные, миофибробласты и др.), обеспечивает актомиозиновый хемомеханический преобразователь. В скелетных МВ и кардиомиоцитах присутствуют сократительные единицы — саркомеры, это поперечнополоcатые мышцы, в ГМК саркомеров нет, это гладкие мышцы. Сократительную функцию скелетной мышечной ткани (произвольная мускулатура) контролирует нервная система (соматическая двигательная иннервация). Непроизвольные мышцы (сердечная и гладкая) имеют вегетативную двигательную иннервацию, а также развитую систему гуморального контроля их сократительной активности. Все мышечные элементы способны к генерации ПД, распространяющихся по клеточной мембране (сарколемме).
Скелетная мышца
У человека более 600 скелетных мышц (около 40% массы тела). Они обеспечивает осознанные и осознаваемые произвольные движения тела и его частей. Структурно-функциональная единица скелетной мышцы — скелетное мышечное волокно (МВ).

Рис. 7-1. Скелетная мышца состоит из поперечнополосaтых мышечных волокон [11]. Значительный объём МВ занимают миофибриллы. Расположение светлых и тёмных дисков в параллельных друг другу миофибриллах совпадает, что приводит к появлению поперечной исчерченности. Структурная единица миофибрилл — саркомер, сформированный из толстых (миозиновых) и тонких (актиновых) нитей. Расположение тонких и толстых нитей в саркомере показано слева и слева внизу. G‑актин — глобулярный, F‑актин — фибриллярный актин.
Миофибриллы
Каждая миофибрилла содержит около 1500 толстых и 3000 тонких нитей. Поперечная исчерченность скелетного МВ (рис. 7–1) определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые (Isotropic, I–диски) и тёмные (Anisotropic, А–диски) диски. Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких (актиновых) и толстых (миозиновых) нитей: толстые нити находятся только в тёмных дисках, светлые диски не содержат толстых нитей. Каждый светлый диск пересекает Z - линия. Участок миофибриллы между соседними Z-линиями определяют как саркомер.
· Саркомер — часть миофибриллы, расположенная между двумя последовательными Z–дисками. В состоянии покоя и полностью растянутой мышце длина саркомера составляет 2 мкм. При такой длине саркомера актиновые (тонкие) нити лишь частично перекрывают миозиновые (толстые) нити. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине сaркомера. Толстые нити занимают центральную часть сaркомера — А–диск (содержащий только толстые нити участок сaркомера — Н-зона, в середине Н-зоны проходит М-линия). I–диск входит в состав двух сaркомеров. Следовательно, каждый сaркомер содержит один А–диск (тёмный) и две половины I–диска (светлого), формула саркомера — 0,5А + I + 0,5А. Во время сокращения длина A–диска не меняется, а I–диска — укорачивается, что и послужило основанием для создания теории, объясняющей сокращение мышцы механизмом скольжения (теория скольжения) тонких актиновых нитей вдоль толстых миозиновых.
· Толстая нить (рис 7–3Б). Каждая миозиновая нить состоит из 300–400 молекул миозина и С‑белка. Миозин (рис 7–3В) — гексaмер (две тяжёлые и четыре лёгкие цепи). Тяжёлые цепи — две спирально закрученные полипептидные нити, несущие на своих концах глобулярные головки. В области головок с тяжёлыми цепями ассоциированы лёгкие цепи. Каждую миозиновую нить связывает с Z–линией гигантский белок титин. С толстыми нитями ассоциированы небулин, миомезин, креатинфосфокиназа и другие белки.

Рис. 7-3. Тонкая и толстая нити в составе миофибрилл [11]. А. Тонкая нить — две спирально скрученные нити фибриллярного актина (F‑актин). В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина трёх типов. Б — толстая нить. Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити. В — молекула миозина. Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и обладает активностью АТФазы.
à Миозин (рис. 7 –3В). В молекуле миозина (мол. масса 480 000) различают тяжёлый и лёгкий меромиозин. Тяжёлый меромиозин содержит субфрагменты (S): S1 содержит глобулярные головки миозина, S2 — прилежащую к головкам часть фибриллярного хвоста молекулы миозина. S2 эластичен (эластический компонент S2), что допускает отхождение S1 на расстояние до 55 нм. Концевую часть хвостовой нити миозина длиной 100 нм образует лёгкий меромиозин. Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (S1—S2–соединение). Половина молекул миозина обращена головками к одному концу нити, а вторая половина — к другому (рис. 7 –3Б). Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает над её поверхностью.
à Титин — наибольший из известных полипептидов с мол. массой 3000 кД — наподобие пружины связывает концы толстых нитей с Z-линией. Другой гигантский белок — небулин (Mr 800 кД) — ассоциирует тонкие и толстые нити.
à С ‑ белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
à Миомезин (М‑белок) и креатинфосфокиназа — белки, ассоциированные с толстыми нитями в середине тёмного диска. Креатинфосфокиназа способствует быстрому восстановлению АТФ при сокращении. Миомезин выполняет организующую роль при сборке толстых нитей.
Иннервация
Двигательная и чувствительная соматическая иннервация МВ скелетных мышц осуществляется соответственно a- и g‑мотонейронами передних рогов спинного мозга и двигательных ядер черепных нервов и псевдоуниполярными чувствительными нейронами спинномозговых узлов и чувствительных ядер черепных нервов. Вегетативная иннервация МВ в скелетных мышцах не обнаружена, но ГМК стенки кровеносных сосудов мышц имеют симпатическую адренергическую иннервацию.
Двигательная иннервация
Каждое экстрафузальное МВ имеет прямую двигательную иннервацию — нервно-мышечные синапсы, образованные терминальными ветвлениями аксонов a‑мотонейронов и специализированными участками плазмолеммы мышечного волокна (концевая пластинка, постсинаптическая мембрана). Экстрафузальные МВ входят в состав нейромоторных (двигательных) единиц и обеспечивают сократительную функцию мышц. Интрафузальные МВ образуют нервно-мышечные синапсы с эфферентными волокнами g‑мотонейронов.
· Двигательная единица (рис. 7–6) включает один мотонейрон и группу иннервируемых им экстрафузальных МВ. Количество и размеры двигательных единиц в различных мышцах значительно варьируют. Поскольку при сокращении фазные МВ подчиняются закону «всё или ничего», то сила, развиваемая мышцей, зависит от количества активируемых (т.е. участвующих в сокращении МВ) двигательных единиц. Каждая двигательная единица образована только быстросокращающимися или только медленносокращающимися МВ (см. ниже).
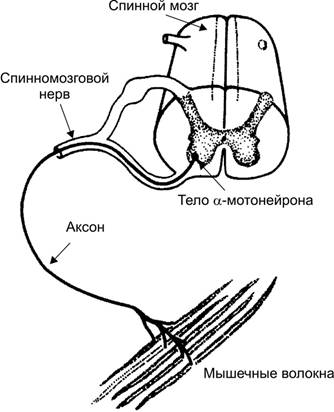
Рис. 7–6. Двигательная единица
· Полинейронная иннервация. Формирование двигательных единиц происходит в постнатальном периоде, а до рождения каждое МВ иннервируется несколькими мотонейронами. Аналогичная ситуация возникает при денервации мышцы (например, при повреждении нерва) с последующей реиннервацией МВ. Понятно, что в этих ситуациях страдает эффективность сократительной функции мышцы.
· Нервно - мышечный синапс. Физиология нервно-мышечных синапсов рассмотрена в главах 4 (см. рис. 4–8) и 6 (см. рис. 6–2, 6–3).
Как и любой синапс, нервно-мышечное соединение состоит из трех частей: пресинаптической области, постсинаптической области и синаптической щели.
à Пресинаптическая область. Двигательная нервная терминаль нервно-мышечного синапса снаружи покрыта шванновской клеткой, имеет диаметр 1–1,5 мкм и образует пресинаптическую область нервно-мышечного синапса. В пресинаптической области в большом количестве присутствуют синаптические пузырьки, заполненные ацетилхолином (5–15 тыс. молекул в одном пузырьке) и имеющие диаметр порядка 50 нм.
à Постсинаптическая область. На постсинаптической мембране — специализированной части плазмолеммы МВ — имеются многочисленные инвагинации, от которых на глубину 0,5–1,0 мкм отходят постсинаптические складки, чем существенно увеличивается площадь мембраны. В постсинаптическую мембрану встроены н‑холинорецепторы, их концентрация достигает 20–30 тысяч на 1 мкм2.

Рис. 7–7. Никотиновый холинорецептор постсинаптической мембраны. А — рецептор не активирован, ионный канал закрыт. Б — после связывания рецептора с ацетилхолином канал кратковременно открывается.
Ä Постсинаптические н‑холинорецепторы (рис. 7–7) Диаметр открытого канала в составе рецептора равен 0,65 нм, что вполне достаточно для свободного прохождения всех необходимых катионов: Na+, K+, Ca2+. Отрицательные ионы, такие как Cl–, не проходят через канал вследствие сильного отрицательного заряда в устье канала. Реально через канал проходят преимущественно ионы Na+ в силу следующих обстоятельств:
Ú в среде, окружающей рецептор ацетилхолина, в достаточно больших концентрациях имеется лишь два положительно заряженных иона: во внеклеточной жидкости Na+ и во внутриклеточной жидкости K+;
Ú сильный отрицательный заряд внутренней поверхности мышечной мембраны (от –80 до –90 мВ) притягивает положительно заряженные ионы натрия внутрь МВ, одновременно предотвращая попытки ионов калия двигаться наружу.
Ä Внесинаптические холинорецепторы. Холинорецепторы присутствуют также в мембране мышечного волокна вне синапса, но здесь их концентрация на порядок величины меньше, чем в постсинаптической мембране.
à Синаптическая щель. Через синаптическую щель проходит синаптическая базальная мембрана. Она удерживает в области синапса терминаль аксона, контролирует расположение холинорецепторов в виде скоплений в постсинаптической мембране. В синаптической щели также находится фермент ацетилхолинэстераза, расщепляющий ацетилхолин на холин и уксусную кислоту.
à Этапы нервно-мышечной передачи. Нервно-мышечная передача возбуждения состоит из нескольких этапов.
Ú ПД по аксону достигает области двигательного нервного окончания.
Ú Деполяризация мембраны нервного окончания приводит к открытию потенциалозависимых Са2+‑каналов и входу Са2+ в двигательное нервное окончание.
Ú Повышение концентрации Са2+ приводит к запуску экзоцитоза квантов ацетилхолина из синаптических пузырьков.
Ú Ацетилхолин попадает в синаптическую щель, где путём диффузии достигает рецепторов на постсинаптической мембране. В нервно-мышечном синапсе в ответ на один ПД выделяется около 100–150 квантов ацетилхолина.
Ú Активация н‑холинорецепторов постсинаптической мембраны. При открытии каналов н‑холинорецепторов возникает входящий Na–ток, что приводит к деполяризации постсинаптической мембраны. Появляется потенциал концевой пластинки, который при достижении критического уровня деполяризации вызывает ПД в мышечном волокне.
Ú Ацетилхолинэстераза расщепляет ацетилхолин и действие выделившийся порции нейромедиатора на постсинаптическую мембрану прекращается.
à Надежность синаптической передачи. В физиологических условиях каждый нервный импульс, поступающий в нервно-мышечное соединение, вызывает возникновение потенциала концевой пластинки, амплитуда которого в три раза больше необходимой для возникновения ПД. Появление такого потенциала связано с избыточностью выделения медиатора. Под избыточностью подразумевается выделение в синаптическую щель значительно большего количества ацетилхолина, чем требуется для запуска ПД на постсинаптической мембране. Этим гарантируется, что каждый ПД мотонейрона вызовет реакцию в иннервируемом им МВ.
à Вещества, активирующие передачу возбуждения
Ú Холиномиметики. Метахолин, карбахол и никотин оказывают на мышцу тот же эффект, что и ацетилхолин. Различие заключается в том, что эти вещества не разрушаются ацетилхолинэстеразой или разрушаются более медленно, в течение многих минут и даже часов.
Ú Антихолинэстеразные соединения. Неостигмин, физостигмин и диизопропилфлуорофосфат инактивируют фермент таким образом, что имеющаяся в синапсе ацетилхолинэстераза теряет способность гидролизовать ацетилхолин, выделяющийся в концевой двигательной пластинке. В результате происходит накопление ацетилхолина, что в ряде случаев может вызывать мышечный спазм. Это может приводить к смертельным исходам при спазме гортани у курильщиков. Неостигмин и физостигмин инактивируют ацетилхолинэстеразу в течение нескольких часов, после чего их действие проходит, и синаптическая ацетилхолинэстераза восстанавливает свою активность. Диизопропилфлуорофосфат, являющийся нервно-паралитическим газом, блокирует ацетилхолинэстеразу на недели, что делает это вещество смертельно опасным.
à Вещества, блокирующие передачу возбуждения
Ú Миорелаксанты периферического действия (кураре и курареподобные препараты) широко применяются в анестезиологии. Тубокурарин препятствует деполяризующему действию ацетилхолина. Дитилин приводит к миопаралитическому эффекту, вызывая стойкую деполяризацию постсинаптической мембраны.
Ú Ботулотоксин и столбнячный токсин блокируют секрецию медиатора из нервных терминалей.
Ú b- и g- Бунгаротоксины блокируют холинорецепторы.
à Нарушения нервно-мышечной передачи. Миастения тяжёлая псевдопаралитическая (myasthenia gravis) — аутоиммунное заболевание, при котором образуются АТ к н‑холинорецепторам. Циркулирующие в крови АТ связываются с н‑холинорецепторами постсинаптической мембраны МВ, препятствуют взаимодействию холинорецепторов с ацетилхолином и угнетают их функцию, что приводит к нарушению синаптической передачи и развитию мышечной слабости. Ряд форм миастений вызывает появление АТ к кальциевым каналам нервных окончаний в нервно-мышечном соединении.
à Денервация мышцы. При двигательной денервации происходит значительное увеличение чувствительности мышечных волокон к эффектам ацетилхолина вследствие увеличенного синтеза рецепторов ацетилхолина и их встраивания в плазмолемму по всей поверхности мышечного волокна.
· Потенциал действия мышечного волокна. Природа и механизм возникновения ПД рассмотрены в главе 5. ПД МВ длится 1–5 мс, скорость его проведения по сарколемме, включая T-трубочки, составляет 3–5 м/с.
Чувствительная иннервация
Чувствительную иннервацию скелетных мышц осуществляют в основном проприорецепторы — мышечные веретёна, сухожильные органы Гольджи, чувствительные нервные окончания в капсуле суставов.
· Мышечные веретёна (рис. 7–8) — чувствительные воспринимающие приборы скелетной мышцы. Их количество в различных мышцах значительно варьирует, но они присутствуют практически во всех мышцах, за исключением некоторых глазных. Основные структурные элементы мышечного веретена — интрафузальные МВ, нервные волокна и капсула.
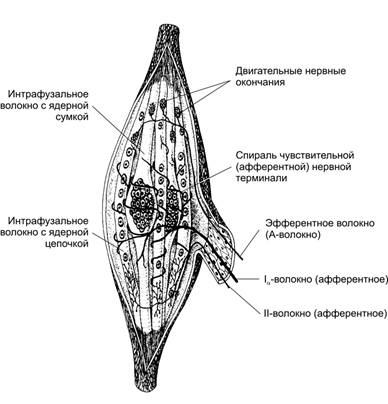
Рис. 7–8. Мышечное веретено [11]. Интрафузальные МВ с компактным скоплением ядер — волокна с ядерной сумкой, в интрафузальных МВ с ядерной цепочкой ядра распределены по длине волокна более равномерно. К веретену подходят афферентные и эфферентные нервные волокна. Аннулоспиральные (первичные) сенсорные окончания образованы безмиелиновыми терминалями афферентных Ia‑волокон в экваториальной зоне обоих типов интрафузальных МВ. Ближе к концам интрафузальных МВ (чаще МВ с ядерной цепочкой) расположены терминали тонких афферентных II-волокон — вторичные окончания. Эфферентные Аg-волокна образуют нервно-мышечные синапсы с интрафузальными МВ в концевой их части.
à Мышечные волокна. Мышечное веретено содержит от 1 до 10 коротких интрафузальных мышечных волокон. В средней (экваториальной) их части ядра образуют компактное скопление (волокна с ядерной сумкой) или располагаются цепочкой (волокна с ядерной цепочкой).
à Нервные волокна. Терминали Ia‑волокон образуют спираль в пределах экваториальной зоны обоих типов интрафузальных МВ (первичные, или аннулоспиральные окончания). Терминали более тонких II-волокон заканчиваются на интрафузальных МВ в области, расположенной рядом с экваториальной (вторичные окончания, чаще встречаются в МВ с ядерной цепочкой). Эфферентные Аg‑волокна образуют нервно-мышечные синапсы с интрафузальными МВ в концевой их части
à Капсула. Комплекс интрафузальных МВ с нервными терминалями окружён многослойной капсулой, наружные слои которой являются производными периневрия, а внутренние рассматриваются как аналоги эндоневрия.
· Сухожильные органы Гольджи (рис. 7–9) расположены в концевой части сухожилия на границе с мышцей, а также в связках капсулы суставов. Рецептор имеет веретеновидную форму и окружён капсулой, состоящей из нескольких слоёв плоских клеток. В образовании сухожильного органа Гольджи участвуют терминали афферентных миелиновых волокон, они ветвятся среди пучков спиралевидных коллагеновых волокон, расположенных в заполненном жидкостью пространстве.
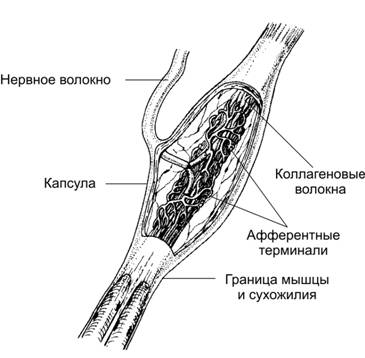
Рис. 7–9. Сухожильный орган Гольджи [11]. Рецептор окружён капсулой, через которую в средней части органа проходит миелиновое нервное волокно, образующее терминальное сплетение среди коллагеновых волокон.
· Чувствительные нервные окончания в капсуле суставов — важный элемент проприоцептивной системы организма.
à Тельца Руффини расположены в периферических участках капсулы.
à Пластинчатые пачиниподобные тельца — сенсорные рецепторы существенно меньших размеров, чем тельца Пачини.
à Свободные нервные окончания — терминали тонких миелиновых волокон и, наконец, терминали безмиелиновых волокон, среди которых, по-видимому, присутствуют и болевые рецепторы. Широко представлены во всех компонентах сустава, но наибольшей плотности достигают в мениске и суставном диске.
Мышечное сокращение
Сокращение мышцы происходит при поступлении по аксонам двигательных нейронов к нервно-мышечным синапсам волны возбуждения в виде нервных импульсов (ПД нервных волокон). Это непрямое сокращение (опосредованное нервно-мышечной синаптической передачей). Возможно и прямое сокращение мышцы. Под ним понимают сокращение групп МВ (мышечные подёргивания, фибрилляции), происходящее при возбуждении любого звена последовательности событий после секреции нейромедиатора из терминалей аксона в нервно-мышечном синапсе. Последовательность этих событий такова: (1) деполяризация постсинаптической мембраны и генерация ПД ® (2) распространение ПД по плазмолемме МВ ® (3) передача сигнала в триадах на саркоплазматический ретикулум ® (4) выброс Ca2+ из саркоплазматического ретикулума ® (5) связывание Ca2+ тропонином С тонких нитей ® (6) взаимодействие тонких и толстых нитей (формирование мостиков), появление тянущего усилия и скольжение нитей относительно друг друга ® (7) Цикл взаимодействия нитей ® (8) укорочение саркомеров и сокращение МВ ® (9) расслабление. Позиции 1–4 рассмотрены выше (см. рис. 7–4 и 7–5 в книге и сопровождающий их текст), а этапы 2–4 представлены на рис. 7–10.
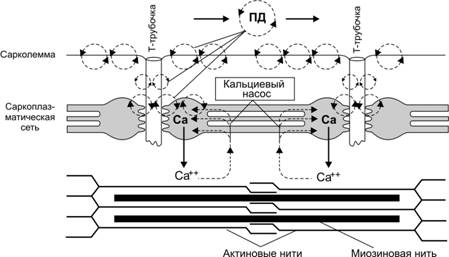
Рис. 7–10. Распространение потенциала действия по сарколемме мышечного волокна и выброс ионов кальция из цистерн саркоплазматического ретикулума
1. Деполяризация постсинаптической мембраны и генерация ПД рассмотрены выше и в главе 6.
2. Плазмолемма и потенциал действия. Локальная деполяризация постсинаптической мембраны приводит к генерации потенциала действия, быстро распространяющегося по всей плазмолемме мышечного волокна (включая Т-трубочки).
à Электромиография — важный диагностический метод — позволяет регистрировать характеристики потенциалов действия.
à Миотония. Уменьшение Cl—-проводимости плазмолеммы ведёт к электрической нестабильности мембраны МВ и к развитию миотонии (например, болезни Томсена).
3. Триады и передача сигнала на саркоплазматическую сеть. Волна деполяризации по Т-трубочкам проникает до триад. В области триад мембрана Т–трубочек в составе потенциалозависимого кальциевого канала содержит рецепторы дигидропиридина. Деполяризация мембраны Т–трубочек вызывает в структуре рецепторов дигидропиридина конформационные изменения, передающиеся на рецепторы рианодина терминальных цистерн саркоплазматического ретикулума.
Злокачественная гипертермия при наркозе (особенно при использовании тиопентала и галотана) — редкое осложнение (смертность до 70%) при хирургическом вмешательстве. Температура тела быстро поднимается до 43 °С и выше, происходит генерализованный распад мышц (рабдомиолиз). В части случаев найдена мутация гена рианодинового рецептора скелетномышечного типа.
4. Саркоплазматический ретикулум и выброс Ca2+. Активация рецепторов рианодина (Ca2+‑канал) приводит к открытию Ca2+‑каналов, Ca2+ из кальциевых депо поступает в саркоплазму; концентрация Ca2+ в саркоплазме достигает значений, достаточных для связывания этого двухвалентного катиона с тропонином С тонких нитей.
5. Связывание Ca2+ тонкими нитями. В покое взаимодействие тонких и толстых нитей невозможно, т.к. миозин-связывающие участки F‑актина заблокированы тропомиозином. При высокой концентрации Ca2+ эти ионы связываются с тропонином C и вызывают конформационные изменения тропомиозина, приводящие к разблокированию миозин-связывающих участков (рис. 7–11).

Рис. 7–11. Ca2+–зависимый механизм регуляции взаимодействия актина с миозином [11]. В покое миозин-связывающие участки тонкой нити заняты тропомиозином. При сокращении ионы Ca2+ связываются с тропонином С, а тропомиозин открывает миозин-связывающие участки. Головки миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити.
6. Взаимодействие тонких и толстых нитей. В результате разблокирования миозин-связывающих участков молекул актина головки миозина, несущие продукты гидролиза АТФ (АДФ + Фн), присоединяются к тонкой нити и изменяют свою конформацию, создавая тянущее усилие: — тонкие нити начинают скользить между толстыми (рис. 7–12). За счёт шарнирного участка в области шейки миозина происходит гребковое движение, продвигающее тонкую нить к центру сaркомера. В результате происходит скольжение тонких нитей относительно толстых. Затем головка миозина связывается с молекулой АТФ, что приводит к отделению миозина от актина. Последующий гидролиз АТФ восстанавливает конформированную молекулу миозина, готовую вступить в новый цикл. Такая модель скользящих нитей была предложена Хью Хаксли.
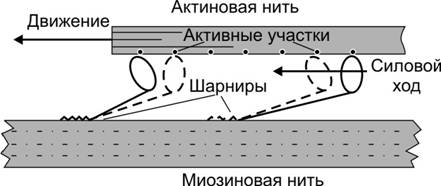
Рис. 7–12. Взаимодействие головки миозина с тонкой нитью и появление тянущего усилия
7. Рабочий цикл. Каждый цикл взаимодействия тонких и толстых нитей имеет несколько стадий (рис. 7–13).

Рис. 7–13. Цикл взаимодействия тонких и толстых нитей [5]. (А) Исходное положение: головка миозина выстоит над толстой нитью (не показана). (Б) Благодаря наличию шарнира между тяжёлым и лёгким меромиозинами, несущая АДФ и Pi головка миозина прикрепляется к актину, происходит поворот головки миозина с одновременным растягиванием эластического компонента S2. (В). Из головки освобождаются АДФ и Фн, а последующая ретракция эластического компонента S2 вызывает тянущее усилие. Затем к головке миозина присоединяется новая молекула АТФ, что приводит к отделению головки миозина от молекулы актина (Г). Гидролиз АТФ возвращает молекулу миозина в исходное положение (А).
8. Укорочение саркомера и сокращение мышечного волокна. Головка миозина совершает около пяти циклов в секунду. Когда одни головки миозина толстой нити производят тянущее усилие, другие в это время свободны и готовы вступить в очередной цикл. Следующие друг за другом гребковые движения подтягивают тонкие нити к центру сaркомера. Скользящие тонкие нити тянут за собой Z-линии, вызывая сокращение сaркомера. Поскольку в процесс сокращения практически одномоментно вовлечены все саркомеры МВ, происходит его укорочение.
Влияние длины саркомера на напряжение мышцы (рис. 7–14). Сопоставление различных длин саркомера показывает, что наибольшее напряжение развивается мышцей при длине саркомера от 2 до 2,2 мкм. Саркомеры такой длины наблюдаются в мышцах, растянутых собственным весом или при небольшой средней нагрузке. В саркомерах размером от 2 до 2,2 мкм филаменты актина полностью перекрывают филаменты миозина. Уменьшение размеров саркомера до 1,65 мкм приводит к снижению напряжения в результате перекрытия филаментами актина друг друга и, следовательно, уменьшения возможности контакта с поперечными мостиками. Большие нагрузки, растягивающие саркомер свыше 2,2 мкм, приводят к падению напряжения, так как в этом случае актиновые филаменты не имеют контакта с поперечными мостиками. Таким образом, мышца развивает максимальное напряжение в условиях полного перекрытия актиновыми филаментами поперечных мостиков миозина.

Рис. 7–14. Саркомер расслабленного (А) и сокращённого (Б) мышечного волокна [11]. При сокращении тонкие нити движутся к центру саркомера, их свободные концы сходятся у М-линии. Вследствие этого уменьшается длина I–дисков и Н-зоны. Длина А–диска не изменяется.
9. Расслабление. Ca2+‑АТФаза сaркоплазматического ретикулума закачивает Ca2+ из сaркоплазмы в цистерны ретикулума, где Ca2+ связывается с кальсеквестрином. В условиях понижения концентрации Ca2+ в саркоплазме тропомиозин закрывает миозин-связывающие участки и препятствует их взаимодействию с миозином. После смерти, когда содержание АТФ в мышечных волокнах снижается вследствие прекращения её синтеза, головки миозина оказываются устойчиво прикреплёнными к тонкой нити. Это состояние трупного окоченения (rigor mortis) продолжается, пока не наступит аутолиз, после чего мышцы можно растянуть.
Ca2+‑насос — основа активного процесса расслабления. Ионы кальция, высвобожденные из саркоплазматического ретикулума и диффундировавшие к миофибриллам, вызывают сокращение, которое будет продолжаться столь долго, сколь долго высокая концентрация ионов Ca2+ будет сохраняться в саркоплазме. Этому препятствует постоянная активность Ca2+ насоса, расположенного в стенках саркоплазматического ретикулума и откачивающего с затратой энергии ионы Ca2+ обратно в просвет саркоплазматического ретикулума. Ca2+ насос повышает концентрацию Ca2+ внутри трубочек в 10 000 раз. Дополнительно работе насоса способствует специальный белок кальсеквестрин, связывающий в 40 раз больше ионов Ca2+, чем их находится в ионизированном состоянии. Таким образом, обеспечивается 40-кратное увеличение запасов кальция. Массивное перемещение ионов Ca2+ внутрь саркоплазматического ретикулума уменьшает концентрацию Ca2+ в саркоплазме до величины 10-7 М и менее. Поэтому, за исключением периода ПД и немедленно сразу после его окончания, концентрация ионов Ca2+- в саркоплазме поддерживается на исключительно низком уровне, и мышца остаётся расслабленной.
Таким образом, при сокращении МВ практически одновременно регистрируются следующие важные характеристики: генерация ПД, выброс ионов кальция в саркоплазму и собственно сокращение (рис. 7–15)

Рис. 7–15. Сокращение мышечного волокна [5]. Последовательное возникновение ПД, пика содержания Ca2+ в саркоплазме и развиваемого напряжения при одиночном мышечном сокращении.
Энергетические потребности.
Мышечное сокращение требует значительных энергетических затрат. Основной источник энергии — гидролиз макроэрга АТФ. В митохондриях в процессе цикла трикарбоновых кислот и окислительного фосфорилирования генерируется АТФ. Гликоген запасaется в сaркоплазме в виде включений. Анаэробный гликолиз сопряжён с синтезом АТФ. Креатинфосфокиназа, связанная в области М-линии, катализирует перенос фосфата от фосфокреатина на АДФ с образованием креатина и АТФ. Миоглобин, как и Hb, обратимо связывает кислород. Запасы кислорода необходимы для синтеза АТФ при длительной непрерывной работе мышцы. На один рабочий цикл затрачивается 1 молекула АТФ. В МВ концентрация АТФ равна 4 ммоль/л. Такого запаса энергии достаточно для поддержания сокращения не более 1–2 сек.
· Затраты АТФ. Энергия АТФ расходуется на:
Ú образование поперечных мостиков, осуществляющих продольное скольжение актиновых филаментов (основная часть энергии гидролиза АТФ);
Ú Ca2+-насос: выкачивание Ca2+ из саркоплазмы в саркоплазматический ретикулум после окончания сокращения;
Ú Na+/K+-насос: перемещение ионов натрия и калия через мембрану МВ для обеспечения соответствующего ионного состава вне- и внутриклеточной среды.
· Восстановление АТФ. Рефосфорилирование АТФ обеспечивается из нескольких источников.
à Креатинфосфат. Первым источником для восстановления АТФ является использование креатинфосфата — вещества, имеющего высокоэнергетические фосфатные связи, подобные связям АТФ. Однако количество креатинфосфата в МВ невелико, всего на 1/5 больше, чем АТФ. Общих запасов энергии АТФ и креатинфосфата в МВ достаточно для развития максимального мышечного сокращения лишь в течение 5–8 сек.
à Гликоген. Вторым источником энергии, который используется в ходе восстановления АТФ и креатинфосфата, является гликоген, запасы которого имеются в МВ. Расщепление гликогена до пировиноградной и молочной кислот сопровождается выделением энергии, которая идёт на превращение АДФ в АТФ. Вновь синтезированный АТФ может использоваться или непосредственно для мышечного сокращения, или в процессе восстановления запасов креатинфосфата. Гликолитический процесс важен в двух аспектах:
Ú гликолитические реакции могут происходить в отсутствие кислорода, и мышца может сокращаться десятки секунд без снабжения кислородом;
Ú скорость образования АТФ в ходе гликолиза в два с лишним раза выше, чем скорость образования АТФ из клеточных продуктов в процессе взаимодействия с кислородом. Однако большое количество промежуточных продуктов гликолитического обмена, накапливаемых в МВ, не позволяет гликолизу поддерживать максимальное сокращение более одной минуты.
à Окислительный метаболизм. Третьим источником энергии является окислительный метаболизм. Более 95% энергии, используемой мышцей в ходе продолжительных, напряжённых сокращений, поступает именно из этого источника. В процессе длительной напряжённой мышечной работы, продолжающейся много часов, большая часть энергии берётся из жиров. Для периода работы от 2 до 4 час более половины энергии поступает за счёт запасов гликогена.
Типы мышечных волокон
Скелетные мышцы и образующие их МВ различаются по множеству параметров — скорости сокращения, утомляемости, диаметру, цвету и т.д. Например, цвет мышцы может быть обусловлен рядом причин: количеством митохондрий, содержанием миоглобина, плотностью кровеносных капилляров. Традиционно выделяют красные и белые, а также медленные и быстрые мышцы и МВ. Каждая мышца — гетерогенная популяция разных типов МВ. Тип мышцы определяют, исходя из преобладания в ней конкретного типа МВ. Применяют следующие классифицирующие критерии типов МВ: характер сокращения (фазные и тонические), скорость сокращения (быстрые и медленные) и тип окислительного обмена (окислительные — красные и гликолитические — белые). На практике результаты типирования МВ комбинируют. Различают три типа МВ — быстросокращающиеся красные, быстросокращающиеся белые и медленносокращающиеся промежуточные. Быстрые МВ приспособлены для выполнения быстрых и мощных сокращений (например, прыжки и бег на короткие дистанции). Медленные МВ адаптированы к продолжительной мышечной деятельности типа удержания тела в выпрямленном положении против сил гравитации или бега на марафонскую дистанцию. В зависимости от преобладания в мышцах конкретного типа МВ скелетные мышцы относят к «красным» и «белым» либо «быстрым» и «медленным». Таким образом, каждая мышца уникальна по спектру входящих в её состав типов МВ. Этот спектр генетически детерминирован (отсюда практика типирования МВ при отборе спортсменов-бегунов — спринтеров и стайеров).
· Фазные и тонические. Экстрафузальные МВ подразделяют на фазные, осуществляющие энергичные сокращения, и тонические, специализированные на поддержание статического напряжения, или тонусa. Произвольная мускулатура человека практически полностью состоит из фазных мышечных волокон, генерирующих ПД. В ответ на нервную стимуляцию они отвечают быстрым сокращением. Тонические мышечные волокна встречаются в наружных ушных и наружных глазных мышцах. Тонические мышечные волокна имеют более низкий МП (от –50 до –70 мВ). Степень деполяризации мембраны зависит от частоты стимуляции. Поэтому лишь повторные