Многоцентровые орбитали
Классическая ковалентная химическая связь образуется между двумя атомами за счет общей пары электронов. В то же время распространены случаи, когда ситуация с образованием связи несколько сложнее.
Пример 1. Молекула азотной кислоты
Рассмотрим, как образуется молекула азотной кислоты: атом азота на валентном уровне имеет три неспаренных электрона и одну неподеленную пару.
Атом азота образует с каждым атомом кислорода одну σ-связь по обменному механизму. Один из атомов кислорода расходует свою валентность на образование связи с атомом водорода, а два других атома кислорода имеют по одному неспаренному электрону. При этом у атома азота сохраняется неподеленная пара на валентном уровне (см. Рисунок 1а):

| 
| 
| 
|
| Рис. 1а | Рис. 1б | Рис. 1в | Рис. 1г |
На рисунке 1б отражена картинка орбиталей: два атома кислорода, у которых на 2p -орбитали по одному неспаренному электрону, и атом азота (посередине), у которого на 2p -орбитали пара электронов. Ясно, что такая картинка напоминает π‑связь атома азота как с атомом кислорода O1, так и с атомом кислорода O2 (Рис. 1в) (перекрывание двух лежащих в одной плоскости p -орбиталей соседних атомов).
В таком случае говорят о формировании трехцентровой (потому что три атома) четырехэлектронной (потому что в π-системе 1+2+1 = 4 электрона) связи. Как видите, в данном случае в связи участвуют не два, а три атома, по этой причине такую связь называют многоцентровой.
Многоцентровую связь на письме отображают пунктирной линией (Рис. 1г).
Альтернативный подход: атом азота образует с одним атомом кислорода две связи по обменному механизму и одну связь по обменному механизму с атомом кислорода гидроксильной группы. Третий атом кислорода может быть связан с атомом азота только по донорно-акцепторному механизму, при котором атом азота выступает донором, а атом кислорода – акцептором.
Экспериментальные данные показывают, что оба атома кислорода, не связанные с атомом водорода идентичны. Следовательно, предложенный подход должен учитывать возможность очень быстрой миграции двойной связи между двумя крайними положениями.

O–N=O D O=N–O
Миграция двойной связи между двумя крайними положениями
Исходя из экспериментальных данных, следует считать, что связи азот-кислород занимают промежуточное значение между одинарной и двойной связями, т.е. кратность связи азот-кислород 1,5 (Рис. 2в).

| 
|
| Рис. 2а | |

| |
| Рис. 2б | |

| |
| Схема образования связей в молекуле азотной кислоты | Рис. 2в |
Таким образом, независимо от использованного подхода, мы получаем одинаковый результат: между атомами кислорода и азота в молекуле азотной кислоты существует трёхцентровая четырёхэлектронная связь.
Важно! Подобное взаимодействие между π-связью и p -орбиталью соседнего атома получило название p -π-сопряжение.
Сопряжение – это явление взаимодействия некоторого числа n соседних p ‑орбиталей, такое что n > 2, при котором образуется единая протяженная система.
Дополнение 1 (в лекции не обсуждалось):
В качестве ещё одного примера сопряжения рассмотрим молекулу уксусной кислоты:
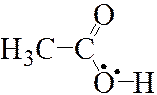
| 
| 
| 
|
| Рис. 3а | Рис. 3б | Рис. 3в | Рис. 3г |
Атом кислорода гидроксильной группы имеет две неподеленные пары электронов на p-орбиталях, одна из которых (Рис. 3а) способная к образованию сопряжения с π‑связью углерод-кислород (Рис. 3б). Поскольку на p -орбитали атома кислорода гидроксильной группы 2 электрона, а на атомах углерода и кислорода по одному, то электроны устремляются из области с большей концентрацией в область с меньшей концентрацией, как показано стрелками (Рис. 3в). Таким образом, на атоме кислорода гидроксильной электронная плотность уменьшается, а на противоположном конце π‑системы электронная плотность возрастает, что отражают заряды (Рис. 3г).