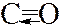1. Строение Периодической Системы («Поле Боя»)
Каждый из присутствующих в аудитории обладает яркой индивидуальностью, особенным талантом. Точно также элементы, собравшиеся вместе в Периодической системе, хоть и похожи порой один на другой, но все-таки имеют свои особенности: сильные и слабые стороны.
Начнем с того, что элементов очень много – и хорошо бы нам их как-нибудь называть, чтобы не запутаться. Давайте соберем в группы близкие по свойствам элементы – электронные аналоги.
Чтобы не запутаться, сперва в два ряда «сложим» f -элементы: лантаноиды и актиноиды.
Затем расположим группы так, чтобы
в элементах первой группы был 1 валентный электрон,
у элементов второй группы – 2 валентных электрона и т.д.
У нас получится 8 групп, в каждой из которых образуется подгруппы: в одной окажутся s - или p -элементы, а в другой – d -элементы.
Например, 1А группа: H, Li, Na, K, Rb, Cs, Fr и 1Б группа: Cu, Ag, Au, Rg
Соберем из групп Периодическую систему. Поскольку периодом называется время между двумя повторяющими событиями, расстояние между двумя соседними электронными аналогами (горизонтальный ряд Периодической системы) будет также называться периодом.
Наконец, дадим названия группам
| Обозначение | Конфигурация | Название |
| IA | ns1 | щелочные металлы и водород |
| IIA | ns2 | щёлочноземельные металлы |
| IIIA | ns2np1 | |
| IVA | ns2np2 | |
| VA | ns2np3 | пниктогены |
| VIA | ns2np4 | халькогены |
| VIIA | ns2np5 | галогены |
| VIIIA | ns2np6 | инертные газы |
| 6s2 5d1 4 f x | лантаноиды | |
| 7s2 6d1 5 f x | актиноиды |
Побочные подгруппы будем назвать по первому их элементу: «подгруппа меди», «подгруппа цинка».
| IB | ns1 (n-1)d10 | подгруппа Cu « |
| IIB | ns2 (n-1)d10 | подгруппа Zn |
| … | … | … |
| VIB | ns1 (n-1)d5 | подгруппа Cr « |
| … | … | … |
| VIIIB | ns2(n-1)d6 ns2(n-1)d7 ns2(n-1)d8 | элементы представлены триадами |
Оказывается, если от бора B к астату At провести диагональ, то неметаллы занимают правый верхний угол, а металлы главных подгрупп – левый нижний. Такие металлы назовем непереходными.
Все элементы побочных подгрупп и f -элементы – переходные элементы, или переходные металлы.
Учитывая, что в природе ничтожные количества (или совсем нет) элементов с Z > 92, назовем такие элементы трансурановыми, т.е. располагающимися «за ураном».
«Электронный «провал» (или электронный «проскок»)
Квантовая механика предсказывает, что наименьшей энергией обладает такое состояние частицы, когда все уровни заполнены электронами либо полностью, либо наполовину.
Поэтому для элементов подгруппы хрома (Cr, Mo, W, Sg) и элементов подгруппы меди (Cu, Ag, Au, Rg) происходит перемещение 1 электрона с n s ‑ на (n-1) d‑ подуровень.
| 24Cr [Ar] 4s23d4 " 24Cr [Ar] 4s13d5 | 29Cu [Ar] 4s23d9 " 29Cu [Ar] 4s13d10 |
Это явление получило название электронный «провал» или электронный «проскок», его следует запомнить.
Подобное явление характерно также и для f -элементов, однако их химия выходит за рамки нашего курса.
Для p-элементов электронный «провал» НЕ наблюдается!
2. Периодический закон
Свойства атомов находятся в периодической зависимости от величины атомных весов (Д.И. Менделеев)
Свойства атомов находятся в периодической зависимости от величины заряда ядра (Современные представления о ПС)
Основные свойства атомов элементов
| Характеристика | Ед. измерения | Диапазон изменения | Изменение в периоде | Изменение в группе |
| Радиус атома | ангстрем (Ǻ) нанометр (нм) | 0,029 нм (He) 0,252 нм (Cs) | уменьшается | растет |
| Потенциал ионизации | эВ или Дж | 3,89 эВ (Cs) 24,6 эВ (He) | растет | уменьшается |
| Сродство к электрону | эВ или Дж | - 0,8 эВ (Ne) 3,6 эВ (Cl) | общая тенденция: растет от I группы к VII | неравномерно, общая тенденция: уменьшается |
| ЭО | - | 0,7 (Cs)… 4,1 (F) | растет | уменьшается |
ЭО – электроотрицательность, шкала Полинга
Примечание: вообще говоря, вся таблица логично построена на компромиссе между ростом заряда ядра и числом энергетических уровней, поэтому запоминать её как таковую не нужно: чем меньше радиус атома, тем сильнее притяжение электронов к ядру, следовательно выше потенциал ионизации и тем больше ЭО элемента.
1. Радиус атома – расстояние от центра ядра до внешнего энергетического уровня. В периоде по мере увеличения заряда ядра радиус атома уменьшается; в группе, наоборот, по мере числа энергетических уровней, радиус атома растет.
Следовательно, в ряду O2-, F-, Ne, Na+, Mg2+ - радиус частицы уменьшается, хотя их конфигурация одинакова 1s2 2s22p6.
Для неметаллов говорят о ковалентном радиусе, для металлов – о металлическом радиусе, для ионов – об ионном радиусе.
2. Потенциал ионизации – это энергия, которую нужно истратить на отрыв от атома 1 электрона. По принципу наименьшей энергии в первую очередь отрывается последний по заполнению электрон (для s и p -элементов) и электрон внешнего энергетического уровня (для d и f -элементов)
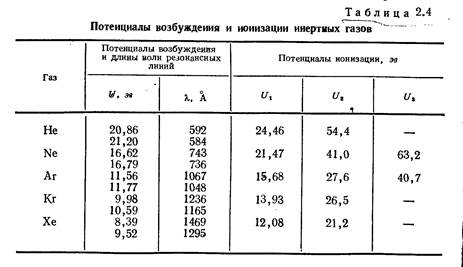
В периоде по мере роста заряда ядра потенциал ионизации растет – в начале периода находится щелочной металл с низким потенциалом ионизации, в конце периода – инертный газ. В группе потенциалы ионизации ослабевают.
Энергия ионизации, эВ
Изменение потенциала ионизации в атомах элементов II периода
| Li | Be | B | C | N | O | F | Ne |
| 5,4 | 9,3 | 8,3 | 11,3 | 14,5 | 13,6 | 17,4 | 21,6 |
Изменение потенциала ионизации в атомах IA группы (щелочных металлов)
| Li | Na | K | Rb | Cs |
| 5,4 | 5,1 | 4,3 | 4,2 | 3,9 |
На приведенном рисунке показаны не только первые потенциалы ионизации (минимальная энергия, чтобы атом потерял 1 электрон), но и следующие: например, второй потенциал ионизации – это энергия, которую нужно затратить, чтобы оторвать еще 1 электрон (в результате всего процесса образуется двухзарядный катион и 2 свободных электрона, а общие затраты энергии равны сумме первого и второго потенциалов ионизации).
3. Сродство к электрону – энергия, выделяющаяся при присоединении к атому электрона, т.е. при образовании аниона.
4. Электроотрицательность (ЭО) – это способность атомов притягивать к себе электронную плотность. В отличие от потенциала ионизации, за которым стоит конкретная измеряемая физическая величина, ЭО – это некоторая величина, которая может быть только рассчитана, измерить её нельзя. Иными словами, ЭО придумали люди, для того, чтобы с её помощью объяснять те или иные явления.
В зависимости от «автора», существуют различные шкалы электроотрицательности, из которых наибольшее распространение получила шкала Полинга (в честь её создателя – Лайнуса Полинга). Обозначают ЭО буквой χ.
Для наших учебных целей требуется запомнить качественный порядок изменения электроотрицательности: F > O > N > Cl > … > H > … > металлы.
ЭО, очевидно, возрастает в периоде (так как увеличивается заряд ядра – сила притяжения электрона и уменьшается радиус атома) и, напротив, ослабевает в группе.
Нетрудно понять, что раз период начинается электроположительным металлом, а заканчивается типичным неметаллом VII группы (инертные газы в расчет не принимаем), то степень изменения ЭО в периоде больше, чем в группе.
5. Степень окисления – это условный (!!!) заряд атома в химическом соединении, вычисленный в приближении, что все связи образованы ионами.
Минимальная степень окисления определяется тем, сколько электронов атом способен принять на валентный уровень, максимальная – сколько электронов атом способен отдать с валентного уровня.
| Эл-т | Эл. Конфиг. | Макс. ст.ок. | Мин. ст.ок. | Диапазон |
| 7N | 1s2 2s22p3 | 1s2, ст.ок. +5 | 1s2 2s22p6, ст.ок. -3 | -3..+5 |
Комментарии:
1. Степень окисления обозначается так: знак, затем цифра, например +5.
Заряд иона обозначается наоборот: цифра, затем знак, например 2+.
2. Степень окисления может быть дробной – это условный заряд.
3. Вообще говоря, степень окисления теоретически может принимать все значения от минимальной для максимальной, но не для всех элементов удается привести более-менее реальные примеры.
Степени окисления азота в соединениях
| -3 | -2 | -1 | +1 | +2 | +3 | +4 | +5 | |
| NH3 | H2N-NH2 | NH2OH | N2 | N2O | NO | HNO2 | NO2 | HNO3 |
Пример определения степеней окисления:
Например, рассмотрим молекулу метанола – метилового спирта (а). Палочки отображают последовательность соединения атомов друг с другом. Рассмотрим по отдельности каждую пару атомов и обозначим стрелочкой смещение электронов к тому атому из пары, ЭО которого больше (б). Следовательно, электроны сместились – и образовались заряды – положительные и отрицательные: на конце каждой стрелочки заряд (-1), соответствующий добавлению 1 электрона; на основании стрелочки заряд (+1), соответствующий удалению 1 электрона.
Получившиеся заряды и есть степень окисления того или иного атома.
(а)  (б)
(б) 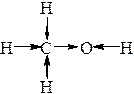 (в)
(в) 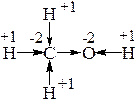
3. Валентные возможности атомов.
Итак, наш вопрос на сегодня: как атомы образуют молекулы и почему эти молекулы не рассыпаются?
Логично предполагать, что если атомы держатся вместе, значит, их что-то связывает. Такое состояние назовем химической связью. Поскольку строение атома для нас секрета не представляет, то остановимся на самом простом возможном объяснении:
Химическая связь – особый тип взаимодействия между атомами в химических соединениях, основанный на взаимодействии положительно заряженных ядер атомов одного элемента с отрицательно заряженными электронами другого элемента.
Проводя аналогию с законом всемирного тяготения, ядро атома, как черная дыра, пытается притянуть любой электрон, попавший в его сферу притяжения.
Типы химической связи. Ковалентная связь.
Как Вы знаете, любое животное ищет себе пару. И электрон не исключение: для того, чтобы образовать прочную химическую связь, нужна пара электронов с противоположно направленными спинами.
Пусть есть 2 атома – A и B, которые взаимодействуют между собой.
В зависимости от способа взаимодействия электроны могут оказаться либо «в фазе» (одинаковый знак волновой функции e 1 и e 2), так что образуется химическая связь, либо «в противофазе» (разные знаки волновых функций), приводящая к отталкиванию атомов друг от друга.
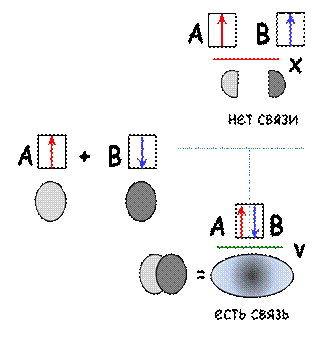
| В первом случае возникает выигрыш в энергии (зеленый уровень энергии V располагается ниже исходного), а его величина равна энергии образующейся связи). Во втором случае возникает проигрыш в энергии (красный уровень X). |
Представьте себе, что Вы катите шарик. Если он катится под горку – Вы не прикладываете никаких усилий – и шарик закатывается в ямку. Напротив, Вы в поте лица толкаете шарик в горку, но, стоит Вам его отпустить – и шарик скатывается к её подножию.
Что происходит при образовании связи с электронным облаком?
Для простоты картинки возьмем сферически симметричные s -АО (l = 0).
1. Если облака (серые шарики) складываются, возникает картинка внизу – есть область перекрывания, в которой электронная плотность «удвоилась», а на остальной области она совпадает либо с плотностью электронного облака атома А, либо с плотностью электронного облака атома B.
В этом случае увеличенная электронная плотность подобно котлете в гамбургере связывает между собой положительно заряженные ядра атомов А и Б.
2. Если же облака (серые шарики) вычитаются, то возникает картинка сверху – посередине полное взаимоуничтожение, а на краях – плотность электронного облака атома до взаимодействия.
В этом случае электронной плотности между ядрами нет – и беспощадный закон Кулона предписывает атомам разлететься в разные стороны.
Итак, ковалентная химическая связь возникает при обобществлении неспаренных электронов с противоположными спинами, изначально принадлежавшим разным атомам.
При этом вступающие в ковалентную химическую связь элементы как бы обмениваются электронами, поэтому такой механизм (способ) образования ковалентной связи получил название – обменный.
| А | # | + | $ | B | = | A | #$ | B |
А· + ·B = A: B
(обобществление электронов, образование общей электронной пары)
А· + ·B = A – B
(образование химической связи,
черточка между А и B обозначает химическую связь и называется валентным штрихом)
Таким образом, для образования ковалентной химической связи по обменному механизму атомы должны иметь неспаренные электроны
Примеры: водород 1H 1s1; кислород 8O … 2s2 2p4.
| 1). | 
| образование молекулы H2 из двух атомов водорода |
| 2). | 
| образование молекулы H2O из двух атомов водорода и атома кислорода |
Например, при образовании молекулы водорода каждый атом предоставляет по 1 e – получается общая (связывающая) пара электронов.
При образовании молекулы воды, на 1 атом кислорода, у которого 2 неспаренных электрона, требуется 2 атома водорода, у каждого из которых по 1 e – образуются 2 связи O – H. При этом атом кислорода располагает также двумя парами электронов (на 2s и на 2p-подуровне), которые в реакции не участвуют. Такие пары называются неподеленными электронными парами.
Изображение у атомов электронов валентного уровня называется структурами Льюиса. При этом рекомендуется электроны разных атомов изображать разными символами, например, ·, *, J, ¶, ♥ и т.п.
Изображение порядка связывания атомов между собой получило название структурных формул. При этом каждая пара электронов на письме заменяется валентным штрихом.
Структурные формулы веществ: H – H, H – O – H, O = O.
Количество ковалентных связей, которое образует данный элемент, называется ковалентностью, или валентностью данного элемента.
Валентность обозначается римскими цифрами.
Таким образом, на данном этапе валентность элемента определяется количеством неспаренных электронов, которые могут принять участие в образовании ковалентных связей.
Валентные возможности элементов.
1. Углерод.
В основном состоянии электронная конфигурация атома углерода 1s2 2s22p2, из которых валентными являются 2s и 2p-электроны.
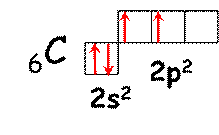
| В таком состоянии атом углерода способен образовать 2 ковалентные связи по обменному механизму. Однако на практике стабильных соединений двухвалентного углерода не существует. Такие частицы (они называются карбенами) иногда образуются в химических реакциях. |
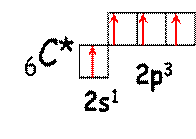
| Вследствие небольшой разницы между 2s и 2p-подуровнем атом углерода при небольших затратах энергии способен переходить в первое возбужденное состояние (обозначается C*). В таком состоянии атом углерода способен образовать 4 ковалентные связи по обменному механизму. |
Примерами стабильных молекул, в которых валентность углерода равна IV, могут служить соединения с водородом, кислородом, …

| 
| 
| 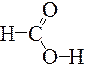
|
| метан | Оксид углерода (IV) Углекислый газ | Циановодород, Синильная кислота N | Муравьиная кислота |
Валентность углерода во всех соединениях равна IV, водорода – I, кислорода – II.
Ацетилен H–C≡C–H – горючий газ, который используется для получения высокотемпературного пламени, например, при сварке.
Вывод: при наличии вакантных орбиталей атомы способны распаривать свои валентные электроны с тем, чтобы увеличить свою ковалентность.
Донорно-акцепторный механизм образования ковалентной связи.
Математика – великая сила. Как следует из вышеизложенного, для образования химической связи требуется 2 электрона (общая электронная пара).
| Очевидно, два электрона можно получить: | 2 = 1 + 1 |
| Однако, существует и другое решение! | 2 = 2 + 0 |
Донорно-акцепторный механизм образования ковалентной связи – способ образования ковалентной связи, при которой один атом (донор) предоставляет для образования связи пару электронов, а другой атом (акцептор) – вакантную (незанятую) орбиталь.
Пример. Строение молекулы монооксида углерода (оксид углерода(II), угарный газ)

| В молекуле монооксида углерода атомы углерода и кислорода связаны двумя ковалентными связями, образованными по обменному механизму. Однако, поскольку у атома углерода есть незаполненная орбиталь на 2p-подуровне, а у атома кислорода – неподеленная пара электронов, то образуется третья ковалентная связь по донорно-акцепторному механизму. |
На письме донорно-акцепторный механизм изображают стрелкой, направленной от атома-донора к атому-акцептору пары электронов.
Правильная структурная формула молекулы монооксида углерода.