Методические указания
К контрольной работе №1
Термодинамический анализ реакции
Дисциплина: Физическая химия
Направление: 18.03.01 Химическая технология
Форма обучения: заочная
Форма проведения: письменная
ФОРМУЛИРОВКА ЗАДАНИЯ
Исследование 1
Для реакции: …(см. вариант задания)
выполнить следующее:
1.1.1. Составить уравнение зависимости от температуры величины  = f (T), теплового эффекта
= f (T), теплового эффекта 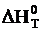 = f(T) и изменения энтропии
= f(T) и изменения энтропии  = f(T).
= f(T).
1.1.2. Вычислить величины  при температурах:
при температурах:
… K. Полученные значения использовать при построении графиков
в координатах  – Т;
– Т; 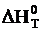 – T;
– T;  – T;
– T;  – T; ln Kp – T; и
– T; ln Kp – T; и  – 1/T.
– 1/T.
1.1.3. Дать термодинамический анализ реакции на основании полученных результатов.
1.1.4. Пользуясь графиком lnКр – 1/T, вывести приближенное уравнение вида
 = А/T + B, где А, В – постоянные и оценить среднее значение теплового эффекта реакции в изученном интервале температур..
= А/T + B, где А, В – постоянные и оценить среднее значение теплового эффекта реакции в изученном интервале температур..
Исследование 2
1.2.1. Используя правило фаз Гиббса, для рассматриваемой системы определить количества фаз, независимых компонентов и число степеней свободы.
1.2.2. Установить направление смещения состояния равновесия рассматриваемой
системы при:
а) увеличении давления (постоянная температура);
б) увеличении температуры (постоянное давление).
РЕШЕНИЕ ЗАДАЧИ
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
 (1)
(1)
где:  – стандартный тепловой эффект реакции при 298 К;
– стандартный тепловой эффект реакции при 298 К;
 - изменение теплоёмкости системы в результате протекания реакции.
- изменение теплоёмкости системы в результате протекания реакции.
Последняя величина рассчитывается по уравнению
 (2)
(2)
где  - мольная изобарная теплоёмкость i-го вещества;
- мольная изобарная теплоёмкость i-го вещества;
ni – стехиометрический коэффициент i-го вещества в уравнении реакции.
После подстановки значений зависимости  от температуры в выражение (2) оно примет вид:
от температуры в выражение (2) оно примет вид:
 = Da + Db T + DcT-2 , (3)
= Da + Db T + DcT-2 , (3)
где: Da = S(ni ai)кон - S(ni ai)исх.
 – рассчитываются аналогично
– рассчитываются аналогично  .
.
Значение  определяется по стандартным теплотам образования
определяется по стандартным теплотам образования 
 = S(ni
= S(ni  )кон - S (ni
)кон - S (ni  )исх. (4)
)исх. (4)
После расчета Da,  и их подстановки в уравнение (3) и (1) получим следующее выражение:
и их подстановки в уравнение (3) и (1) получим следующее выражение:
 = Х + DaТ + Db/2 Т2 - Dс/ Т-1 (5)
= Х + DaТ + Db/2 Т2 - Dс/ Т-1 (5)
Постоянная интегрирования Х определяется из граничных условий:
Т=298 К;  =
= 
X =  - Da 298 –1/2 Db 2982 + Dc/ 298-1
- Da 298 –1/2 Db 2982 + Dc/ 298-1
Изменение энтропии системы в результате протекания процесса определяется по уравнению:
 (6)
(6)
В этом уравнении  – cтандартное изменение энтропии для реакции при 298К, определяемое по мольным стандартным энтропиям веществ
– cтандартное изменение энтропии для реакции при 298К, определяемое по мольным стандартным энтропиям веществ 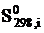 :
:
 = S(ni
= S(ni 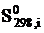 )кон - S(ni
)кон - S(ni 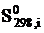 )исх (7)
)исх (7)
Подстановка выражения (3) в уравнение (6) приводит в результату:
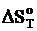 = Y + Da lnТ + Db Т - Dс//2 Т-2 (8)
= Y + Da lnТ + Db Т - Dс//2 Т-2 (8)
Постоянная интегрирования Y определяется из граничных условий:
Т=298 К; 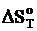 =
=  .
.
Y =  - Da ln298 - Db 298 + Dc/ 298-2/ 2
- Da ln298 - Db 298 + Dc/ 298-2/ 2
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся точным уравнением энтропийного варианта Гиббса-Гельмгольца:
 (9)
(9)
Для реакций, в которых участвуют только газы или газы и конденсированные фазы, представляющие собой чистые вещества, константу равновесия Ка выражают обычно через равновесные парциальные давления (Pi) и обозначают символом Kp.
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
 (10)
(10)
После подстановки выражения (8) в уравнение (9) получим:
 . (11)
. (11)
ПОДГОТОВКА ДАННЫХ ДЛЯ РАСЧЕТОВ
Для удобства последующих расчетов составляем таблицу исходных данных.
Таблица 1
Исходные данные для термодинамического исследования реакции (по данным [1])
| Вещество |  кДж/моль
кДж/моль
| 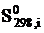 Дж/К мол
Дж/К мол
| a | b· 103 | C/· 10-5 | Температура Т, K |
| ∆ |
УРАВНЕНИЯ ДЛЯ РАСЧЕТОВ
С учетом данных, представленных в табл.!, получаем следующие уравнения для расчета:
 = …. +……10-3 · T +……. 10+5 · T-2 ,
= …. +……10-3 · T +……. 10+5 · T-2 ,
Х = 1000  - Da 298 - Db/2 2982 + Dс/ 298-1 = ………. Дж
- Da 298 - Db/2 2982 + Dс/ 298-1 = ………. Дж
Y =  - Da ln298 - Db 298 + Dс//2 298-2 = …………Дж/К
- Da ln298 - Db 298 + Dс//2 298-2 = …………Дж/К
 = Х + DaТ + Db/2 Т2 - Dс/ Т-1 = ……..+ …. Т + ……10-3 Т2 -…….105 Т-1
= Х + DaТ + Db/2 Т2 - Dс/ Т-1 = ……..+ …. Т + ……10-3 Т2 -…….105 Т-1
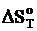 =Y + Da lnТ + Db Т - Dс//2 Т-2 =……+ …..ln Т + ……10-3 Т - ……105Т-2
=Y + Da lnТ + Db Т - Dс//2 Т-2 =……+ …..ln Т + ……10-3 Т - ……105Т-2
Решение задачи выполнено на персональном компьютере и представлено в таблице 2.
Таблица 2
Сводная таблица термодинамических характеристик реакции
| Т, K |  Дж/К
Дж/К
|
 кДж кДж
| 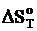 Дж/К
Дж/К
| 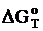 кДж
кДж
| Ln Kp | 1000/T |