(dDН)/(dT) = 
Знак  определяет вид кривой на рисунке 2 (убывающая, возрастающая и экстремальная зависимость).
определяет вид кривой на рисунке 2 (убывающая, возрастающая и экстремальная зависимость).
Рис.2. Зависимость теплового эффекта от температуры
Зависимость на рис.2 позволяет найти не только значения теплового эффекта при любой температуре в заданном интервале температур, но и определить величину  в пределах ………………… К. Например, определим
в пределах ………………… К. Например, определим  рассматриваемой реакции при температуре..… К. Из дифференциальной формы закона Кирхгофа (dDН)/(dT) =
рассматриваемой реакции при температуре..… К. Из дифференциальной формы закона Кирхгофа (dDН)/(dT) =  , следует, что тангенс угла наклона касательной, проведённой к кривой при выбранной температуре, даёт искомую величину
, следует, что тангенс угла наклона касательной, проведённой к кривой при выбранной температуре, даёт искомую величину  (см. рис. 1).
(см. рис. 1).
Чтобы определить численное значение  возьмём на касательной две произвольные точки “a” и ”b”. Можно записать:
возьмём на касательной две произвольные точки “a” и ”b”. Можно записать:

Расчет  по уравнению (3а) даёт близкие к найденному графическим способом значения..
по уравнению (3а) даёт близкие к найденному графическим способом значения..
Внимание! Следует прокомментировать изменение величины теплового эффекта в изученном интервале температур (меняется ли знак 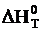 и на сколько процентов изменилась величина
и на сколько процентов изменилась величина 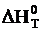 по сравнению с
по сравнению с  )
)
5.3. При комнатной температуре изменение энтропии составляет  = ……..Дж/К, т.е. реакция протекает с увеличением (уменьшением) беспорядка.
= ……..Дж/К, т.е. реакция протекает с увеличением (уменьшением) беспорядка.
Внимание! Если величина  превышает ± 100 Дж/К, изменение беспорядка считается большим и вызвано изменением числа молей газообразных веществ.
превышает ± 100 Дж/К, изменение беспорядка считается большим и вызвано изменением числа молей газообразных веществ.
Значения 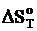 при всех выбранных температурах, приведенные в таблице 2, данные сведём в таблицу 4.
при всех выбранных температурах, приведенные в таблице 2, данные сведём в таблицу 4.
Таблица 4
Изменение энтропии в реакции 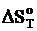 при различных температурах
при различных температурах
| Т, K | |||||||
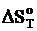 Дж/К Дж/К
|
По данным табл. 4 построим зависимость 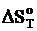 = f(Т) на рис.3.
= f(Т) на рис.3.
Рисунок 3. Изменение энтропии в реакции
На рисунке 3 видно, что изменение энтропии в реакции с температурой аналогично изменению энтальпии на рисунке 2, и объясняется знаком и величиной производной
d(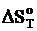 ) / dT =
) / dT =  /T
/T
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся точным уравнением Гиббса-Гельмгольца:
 (8)
(8)
Найденные величины изменения стандартной энергии Гиббса приведены в табл. 5, по данным которой построена зависимость 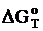 = f(Т), изображенная на рис. 4.
= f(Т), изображенная на рис. 4.
Таблица 5.
Значения изменения стандартной энергии Гиббса (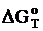 ) при различных температурах
) при различных температурах
| Т, K | |||||||
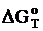 кДж кДж
|
Рис. 4. Стандартное химическое сродство в реакции
Из таблицы 5 и рис. 4 следует что…………………………(объяснить возможное направление реакции по знаку 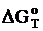 . Если величина
. Если величина 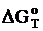 меняет знак, указать
меняет знак, указать
температуру, при которой меняется знак).
Характер зависимости стандартного химического сродства от температуры определяется знаком и величиной изменения энтропии:
d (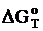 ) / dT = –
) / dT = – 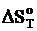 ,
,
т.е. видом графика на рисунке 4.
5.4. Константа равновесия реакции
Для реакций, в которых участвуют только газы или газы и конденсированные фазы, представляющие собой чистые вещества, константу равновесия Ка выражают обычно через равновесные парциальные давления (Pi) и обозначают символом Kp.
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
 (9)
(9)
После подстановки выражения (8) в уравнение (9) получим:
 . (10)
. (10)
Если полагать, что в сравнительно небольшом интервале температур тепловой эффект реакции (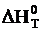 ) и изменение энтропии (
) и изменение энтропии ( ) практически постоянные величины (это подтверждают и результаты табл. 3 и 4). Отсюда уравнение можно записать в виде:
) практически постоянные величины (это подтверждают и результаты табл. 3 и 4). Отсюда уравнение можно записать в виде:
lnKp = (A/T) + B, (11)
Где А и В – постоянные, которые соответственно равны:
A = - 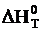 /R (12)
/R (12)
B =  /R (13)
/R (13)
Уравнение (11) отвечает линейной зависимостью lnКp = f(1/T). Определим коэффициенты А и В графически. С этой целью по уравнению (9) и данным табл.5 расcчитаем величину lnKp в заданном интервале температур. Например, для температуры …К:
lnKp, … = - 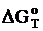 / (R•…) = (…)/(8,31•…) = …
/ (R•…) = (…)/(8,31•…) = …
Константа равновесия, соответствующая полученному значению lnKp,,…, вычисляется следующим образом:
lnKp,… = е… = ………; Kp = …………
Аналогично рассчитываем lnKp и Кp и при других температурах. Полученные значения этих величин сведем в табл. 6.
Таблица 6.
Величины констант равновесия при различных температурах
| Т, К | |||||||
| LnKp | |||||||
| 1000/Т К-1 |
По данным табл. 6 строим зависимость lnKз = f(1/Т), на рис.5.
В комментарии к таблице 6 указать характер обратимости реакции и температуру, вблизи которой реакция практически обратима, т.е. значение Ка близко к единице (-4 > lnKa < +4).
Рис. 5. Зависимость константы равновесия реакции от температуры
Вид кривой на рис. 5 определяется уравнением изобары реакции (уравнением Вант-Гоффа):
d (ln Kp) / dT = 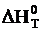 / RT2
/ RT2
Реакция сопровождается выделением теплоты (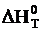 < 0) (поглощением теплоты
< 0) (поглощением теплоты
(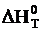 > 0)), поэтому на рис. 5 зависимость ln Kp от температуры убывающая (возрастающая).
> 0)), поэтому на рис. 5 зависимость ln Kp от температуры убывающая (возрастающая).
Если точки на графике (рис. 6) практически ложатся на прямую, выполняются следующие действия. Тангенс угла прямой к оси абсцисс численно равен коэффициенту А в уравнении (11). Для нахождения величины тангенса проведем на рис. 6 прямую, возьмём на ней произвольно две точки “а” и ”b” и определим численные значения их ординат и абсцисс. Можно записать:

 …….
…….
Для определения численного значения В поступим следующим образом. Из табл. 6 возьмём значение ln Кр при …К (…), подставим его вместе с численным коэффициента А (…), найденным ранее, в уравнение (11), предварительно выразив его через В.
B = lnKp – A/T = … = ….
Рис. 6. Определение теплового эффекта реакции
Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид:
lnKp = (…/T) – …. (14)
Последнее уравнение позволяет рассчитать значение Кр при любой температуре, если последняя находится в заданном интервале (т.е. в пределах … – …К) или незначительно выходит за этот интервал.
По значениям коэффициента А и В рассчитаем величину среднего теплового эффекта реакции (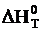 )и изменения энтропии (
)и изменения энтропии ( ). Согласно уравнениям (12) – (13) имеем:
). Согласно уравнениям (12) – (13) имеем:
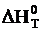 = -A•R = …•8,31 = …. Дж
= -A•R = …•8,31 = …. Дж
 = B•R = …•8,31 = ….Дж/К
= B•R = …•8,31 = ….Дж/К
Полученные данные должны согласуются с данными, приведенными в табл. 2 и 4.
Исследование 2
В этом исследовании нужно для рассматриваемой системы рассчитать число степеней свободы.
2.1.1. Определение числа фаз, независимых компонентов и степеней свободы..
Число независимых компонентов (k) равно наименьшему числу веществ, необходимых для выражения состава всех фаз системы. Это число определяют как общее число веществ в системе (m) за вычетом числа связей между ними (r). Связь между веществами, входящими в рассматриваемую систему, выражается уравнением реакции. Следовательно:
K = m – r = …… (15)
Число степеней свободы (C - вариантность системы) равно числу независимых компонентов системы (давления, температуры, концентрации компонентов), которые можно изменить в некоторых пределах так, чтобы число и природа фаз оставались прежними. По правилу фаз Гиббса:
С = K + n – f, (16)
где n – число внешних параметров, влияющих на состояние равновесия системы. Обычно это давление и температура, т.е. n = 2.
Для рассматриваемой системы:
с = К – f + n = ………..
Значит, равновесный состав газовой фаза, например об.%....... зависит от ……факторов: ………………….(температуры, давления, концентрации).
3.1.2. Установление направления смещения равновесия.
Качественно направления смещения состояния равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается воздействие, то в системе происходят такое смещение равновесия, которое ослабляет это воздействие.
Реакция (1) идет с выделенем тепла(∆H0т< 0), следовательно, при повышении температуры равновесие должно смещаться справа налево, так как образование исходных веществ из конченных продуктов является эндотермическим процессом и его протекание ослабляет произведенное на систему воздействие. Этот вывод согласуется с характером изменения величины Kp в зависимости от температуры (см. табл.6).
Если протекание реакции сопровождается изменением числа молей гозообразных продуктов (Δn ≠ 0), то давление влияет на состояние равновесия. Увеличение давления смещает равновесие в сторону веществ, занимаюших меньший обьём. В нашем случае увеличение давления смещает равновесие …………….т.е. в сторону ……….
Список литературы
- Краткий справочник физико-химических величин. Ред. А.А.Равдель и А.М.Пономарева – СПб: Иван Федоров, 2003. –240 стр.
- Пономарёва К.С., В.Г. Гугля, Никольский Г.С. Сборник задач по физической химии. – Москва: МИСИС, 2007. – 337с.
Приложение 1.
Химические реакции к контрольной работе № 1
| Вариант № | Уравнение реакции | Т1 К | Т2 К | Шаг, град. |
| 2 C + O2 = 2 CO | ||||
| C + O2 = CO2 | ||||
| 2 CO + O2 = 2 CO2 | ||||
| C + CO2 = 2 CO | ||||
| 2 H2 + O2 = 2 H2Oгаз | ||||
| С + Н2Огаз = СО + Н2 | ||||
| С + 2 Н2Огаз = 2 Н2 + СО2 | ||||
| CO + H2Oгаз = CO2 + H2 | ||||
| CaCO3 = CaO + CO2 | ||||
| MgCO3 = MgO + CO2 | ||||
| PbCO3 = PbO + CO2 | ||||
| FeO + CO = Fea + CO2 | ||||
| FeO + H2 = Fea + H2Oгаз | ||||
| Fe3O4 + CO = 3 FeO + CO2 | ||||
| Fe3O4 + H2 = 3 FeO + H2Oгаз | ||||
| NiO + H2 = Nia + H2Oгаз | ||||
| NiO + CO = Nia + CO2 | ||||
| MnO + H2 = Mn + H2Oгаз | ||||
| MnO + CO = Mn + CO2 | ||||
| FeO + Cграфит = СО + Fea | ||||
| Fe2O3 + Cграфит = 3 FeO + CO | ||||
| Si + O2 = SiO2 кварц | ||||
| 2 Fea + O2 = 2 FeO | ||||
| NiO + Cграфит= Nia + CO | ||||
| MnCO3 = MnO + CO2 | ||||
| 2 FeSa + 3 O2 = 2FeO + 2SO2 | ||||
| 2 FeO + Si = 2Fe+ SiO2 | ||||
| SiO2+2Mn=Si+2MnO | ||||
| SiO2+2C=Si+2CO | ||||
| CaO+3C=CaC2+CO | ||||
| 3FeO+2Al=Al2O3+3Fe | ||||
| MnO + C = Mn + COг | ||||
| 2/3Fe2O3 + Si = 4/3 Fe + SiO2 | ||||
| 2/3Fe2O3 + C = 4/3 Fe + 2CO | ||||
| 3Fe2O3 + CO = 2 Fe3O4 + CO2 | ||||
| Fe3O4 + CO = 3 FeO + CO2 | ||||
| 3Fe2O3 + H2 = 2 Fe3O4 + H2O | ||||
| Fe3O4 + H2 = 3 FeO + H2O |
Составил: доцент _____________________ Е.В. Нефедова
(подпись)
Зав. кафедрой _____________________ А.В. Швалева
(подпись)