Применение таблиц
«Термодинамические свойства газов»
В расчетах
Издательство Иркутского государственного технического университета
Термодинамические основы составления таблиц термодинамических свойств газов и методы расчета процессов.
Как известно уравнение адиабатного процесса имеет вид:
РVk = const, где К = 
Очень часто при аналитическом расчете этого процесса принимают, К = const, но даже в этом случае задача довольно трудоемкая. В действительных процессах, происходящих в газовых турбинах и двигателях внутреннего сгорания, температура газа изменяется в значительных пределах.
В этих случаях следует учитывать нелинейную зависимость теплоемкости от температуры, аналитических зависимостей для адиабатного процесса вообще нет.
Для расчета процессов идеального газа были разработаны и предложены таблицы термодинамических свойств газов. При составлении таблиц считается, что во всей области состояний, рассматриваемых в таблицах, газ подчиняется уравнению состояния идеального газа РV = RT. Внутренняя энергия энтальпия газа, подчиняющегося этому уравнению, зависят только от температуры, поэтому таблицы составлены но одному параметру /температуре/.
Уравнения 1 и 2 законов термодинамики можно записать в форме TdS = =dh - VdP или TdS = CpdT - VdP, для изоэнтропного процесса 0 = CpdT - VdР.
С учетом уравнения состояния  и после интегрирования получаем RCn ·
и после интегрирования получаем RCn · 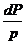 =
=  где: Р0, Т0 - давление и температура газа в каком-либо фиксированном состоянии.
где: Р0, Т0 - давление и температура газа в каком-либо фиксированном состоянии.
Р, Т - параметры произвольного состояния. В правой части уравнения стоит изменение энтропии в изобарном процессе между температурами Т0 и Т. Обозначим это изменение энтропии через S0.
Отношение давлений  обозначим
обозначим 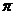 0 назовем относительным давлением, тогда R ln
0 назовем относительным давлением, тогда R ln 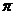 0 = S0 = f(T).
0 = S0 = f(T).
Как видим относительное давление является функцией температуры /если какую-либо температуру го принять за базовую/ и может быть вычислено с нелинейной зависимости С = f(T) через изменение энтропии в изобарном процессе.
Рассмотрим два адиабатных процесса с общим начальным состоянием Р0 и T0 и конечным состоянием 1 и 2, соответственно в этих состояниях давления и температуры P1Т1, и P2T2.
Тогда R ln 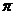 01 = S0Т1 = f(Т1)
01 = S0Т1 = f(Т1)
R ln 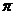 02 = S0Т2 = f(Т2)
02 = S0Т2 = f(Т2)
Или R ln 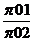 = S0Т2 - S0Т1 = f(Т2) - f(Т1)
= S0Т2 - S0Т1 = f(Т2) - f(Т1)
Очевидно, что для изоэнтропного процесса
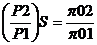
Объединенное уравнение 1 и 2 законов термодинамики можно записать в таком виде
dS = Cp 
Значение энтропии какого-либо произвольного состояния с параметрами Р, Т определим, приняв отсчет от состояния Р0 = I бар и Т0, т.е. считаем, что в состоянии Р0, Т0 энтропия SP0,T0 = 0;
S =  - R ln Р = S0T - R ln Р
- R ln Р = S0T - R ln Р
Рассмотрим теперь два состояния 1 и 2 с параметрами Р1, Т1 и P2, Т2. Энтропию газа в этих состояниях можно определить
S1 = S0T1 - R ln Р1
S2 = S0T2 - R ln Р2
Изменение энтропии
S2 – S1 = S0T2 – S0T1 – R ln 
Для адиабатного процесса  S = 0,
S = 0,

Соответствующее отношение удельных объемов также является функцией температуры и определяется выражением
R ln  = -
= -  ,
, 

Введение безразмерных величин (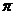 и Q) позволяет выразить отношение давлений и отношение объемов между начальным и конечным состояниями в адиабатном процессе простым отношением этих величин, которые могут быть определены с точностью, даваемой нелинейной зависимостью С = f(Т). Это обстоятельство облегчает и уточняет расчет адиабатного процесса изменения состояния газа.
и Q) позволяет выразить отношение давлений и отношение объемов между начальным и конечным состояниями в адиабатном процессе простым отношением этих величин, которые могут быть определены с точностью, даваемой нелинейной зависимостью С = f(Т). Это обстоятельство облегчает и уточняет расчет адиабатного процесса изменения состояния газа.
Значения 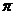 0, Q0, S0 для различных газов подсчитаны в функции температуры и приведены таблицах. Таблицы составлены с учетом нелинейной зависимости С = f(T), в них приводятся также значения энтальпий h - кДж / кмоль; внутренней энергии
0, Q0, S0 для различных газов подсчитаны в функции температуры и приведены таблицах. Таблицы составлены с учетом нелинейной зависимости С = f(T), в них приводятся также значения энтальпий h - кДж / кмоль; внутренней энергии
U,  U,
U,  S0Т.
S0Т.
Пользуясь таблицами можно легко вычислить значения h, U, S для произвольного состояния идеального газа с параметрами Р, Т (за базовую температуру принят абсолютный ноль), а также изменение энтропии S2 – S1 между любыми Р1) Т1, и Р2, Т2, считая С  const. Рассмотрим примеры расчета процессов с помощью таблиц.
const. Рассмотрим примеры расчета процессов с помощью таблиц.
Пример № 1.
В дизеле (двигатель внутреннего сгорания) воздух сжимается таким образом, что его температура становится больше температуры воспламенения топлива. Какое минимальное давление должен иметь при этом воздух, если температура воспламенения топлива 8000С?
Во сколько раз при этом уменьшится его объем? Начальная температура воздуха t0 = 800 с, начальное давление Р1 = 1 бар.
а) при К = 1,4 = const, по известным соотношениям находим:
Р2 = Р1( )к/к-1 = 1 · (
)к/к-1 = 1 · ( ) = 3,043,5 = 48 бар
) = 3,043,5 = 48 бар
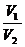 =(
=( )1/к-1= 480,715 = 16
)1/к-1= 480,715 = 16
б) при кm = const, К = К0 -  = 1,41 -
= 1,41 -  = K = 1,373
= K = 1,373
Р2 = Р1 · ( )3,68 = 60 бар
)3,68 = 60 бар
в) при К  const, по таблицам находим:
const, по таблицам находим:
t1 = 800 С, Q01 = 4216, 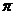 01 = 2,4553
01 = 2,4553
t2 = 8000 C, Q02 = 203,5, 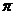 02 = 151,30
02 = 151,30
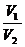 =
=  =
=  = 20,7
= 20,7
 =
=  ; Р2 = Р1 ·
; Р2 = Р1 ·  = l ·
= l · 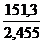 = 61,7 бар
= 61,7 бар
Пример, наглядно показывает, что расчет адиабатного процесса по таблицам более прост и точен.
Пример № 2.
Воздух всасываемый в компрессор при давлении Р = 0,1 МПа и температуре 200 С, сжимается до давления 0,4 МПа. Определить теоретическую работу адиабатного сжатия внутреннем относительном к.п.д. компрессора 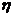 0i = 0,85, температура воздуха в конце сжатия и изменение энтропии.
0i = 0,85, температура воздуха в конце сжатия и изменение энтропии.
Из таблицы находим для t1 = 200 С  01 = 1,2788,
01 = 1,2788,
h1 = 293,3 кДж/кг, S0T1 = 6,6790 кДж/кг·к;
Для определения конечного состояния воздуха найдем относительное давление:
 =
=  = 4;
= 4; 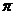 02 = 4 · 1,2788 = 5,1152
02 = 4 · 1,2788 = 5,1152
Из таблицы интерполяцией определим значения
h2 = 436,3 кДж/кг, S0T2 = 7,0769 кДж/кг·к; t2 = 161,70 С
соответствующие 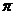 02.
02.
Теоретическая работа сжатия: h2 – h1 =  h = 436,3 - 293,3 = 143 Кдж/кг
h = 436,3 - 293,3 = 143 Кдж/кг
Действительная работа сжатия при 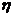 0i = 0,85
0i = 0,85
h2g – h1 =  hg =
hg =  = 168,2 Кдж/кг
= 168,2 Кдж/кг
Энтальпия воздуха в конце сжатия
h2g= h1 +  hg = 293,3 + 168,2= 461,5 кДж/кг
hg = 293,3 + 168,2= 461,5 кДж/кг
Из таблицы находим t2g = 186,440 С (h2g = 461,5 кДж/кг)
S°T2g = 7,1333 кДж/кг
Изменение энтропии в процессе сжатия:
 S = S°T2g - S°T2 = 7,1333 - 7,0769 = 0,05664 кДж/кг·к
S = S°T2g - S°T2 = 7,1333 - 7,0769 = 0,05664 кДж/кг·к
В рассмотренных примерах приведен расчет процессов однородного газа воздуха, но поскольку адиабатный процесс в ГТУ и других двигателях осуществляется чаще всего смесью газов - продуктов сгорания, наиболее важно обеспечить точный расчет адиабатного процесса для смеси газов.
Теоретическая работа адиабатного процесса расширения смеси газов в некоторых случаях определяется как сумма работ компонентов смеси, расширяющихся раздельно при том же отношении давлений.
Например, при начальной температуре смеси t1 = 500° С и отношении начального давления к конечному  = 5 для принятого мольного состава смеси по таблицам найдены следующие конечные температуры компонентов смеси при их раздельном расширении:
= 5 для принятого мольного состава смеси по таблицам найдены следующие конечные температуры компонентов смеси при их раздельном расширении:
| мольная доля % | конечная температура | |
| СО2 | 7,5 | 315,42 |
| Н2О | 6,0 | 264,84 |
| О2 | 10,0 | 238,2 |
| 76,5 | 223,9 |
Теоретическая работа моля смеси, найденная как сумма произведений мольной доли газа на изменение мольной энтальпии при расширении от общей начальной темпере туры до конечной температуры каждого газ при его раздельном расширении, получена равной:
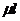 =
= 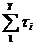 = (
= ( h500 1i -
h500 1i -  h i22i) = 8463 кДж/кмоль
h i22i) = 8463 кДж/кмоль
Однако работа обратимого адиабатного расширения смеси газов отличается от суммы работ компонентов смеси при раздельном расширении с тем же отношением давлении  . При адиабатном расширении индивидуальных газов вследствие различных показателей адиабаты, особенно газов различной атомности, при одинаковых начальной температуре и отношении давлений
. При адиабатном расширении индивидуальных газов вследствие различных показателей адиабаты, особенно газов различной атомности, при одинаковых начальной температуре и отношении давлений  , конечная температура в конце процесса расширения каждого газа получается различной.
, конечная температура в конце процесса расширения каждого газа получается различной.
В процессе же обратимого адиабатного расширения смеси как промежуточные, так и конечные температуры газов смеси должны получаться одинаковыми, т.е. в течение процесса происходить еще некоторый обмен энергией между молекулами разных газов смеси, в результате чего работа обратимого адиабатного расширения смеси изменится.
Метод расчета адиабатного процесса, рассмотренный выше, использует равенство нулю изменение энтропии в обратимом адиабатном процессе, откуда получается равенство
 = R ln
= R ln 
Для смеси газов это условие при расчете обратимого адиабатного процесса принимает вид
 (
( S0 2i -
S0 2i -  S01i) =
S01i) =  R ln
R ln 
причем, поскольку для всех газов  R = idem, для моля смеси правая часть уравнения не зависит от состава смеси, а только от отношения давлений. Поэтому все расчеты адиабатного процесса следует делать только для моля смеси, а смесь задавать в мольных (объемных) долях
R = idem, для моля смеси правая часть уравнения не зависит от состава смеси, а только от отношения давлений. Поэтому все расчеты адиабатного процесса следует делать только для моля смеси, а смесь задавать в мольных (объемных) долях  .
.
Конечные параметры температура смеси могут быть определены с помощью таблиц компонентов по следующему методу.
Для смеси предварительно принимают конечную температуру адиабатного процесса по ее значению для явно преобладающего компонента. В продуктах сгорания преобладающим компонентом всегда является азот, для которого изменение температуры получается обычно наибольшим. Поэтому, найдя по таблицам при тех же условиях конечную температуру чистого азота и округлив ее до десятков градусов t2, для удобства дальнейшей интерполяции при расширении в большую сторону, а при сжатии в меньшую, следует рассчитать предварительное изменение мольной энтропии смеси при Р=const от Т, до Т2 (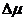 S0см).
S0см).
Сравнив полученное предварительное изменение мольной энтропии смеси по изобаре (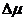 S0см) с рассчитанным изменением энтропии по изотерме (
S0см) с рассчитанным изменением энтропии по изотерме (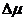 ln
ln  ), нужно изменить предварительное значение конечной температуры на 100С с целью захватить величину
), нужно изменить предварительное значение конечной температуры на 100С с целью захватить величину 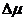 S0см «в вилку», а затем интерполируя в интервале температур 100 С найти окончательную конечную температуру обратимого адиабатного процесса смеси газов.
S0см «в вилку», а затем интерполируя в интервале температур 100 С найти окончательную конечную температуру обратимого адиабатного процесса смеси газов.
При условиях рассматриваемого примера изменение мольной энтропии смеси по изотерме при заданном отношении давлений
 R ln
R ln  = 8,3143 · 2,3026 5 = 13,38 кДж / кмоль·к
= 8,3143 · 2,3026 5 = 13,38 кДж / кмоль·к
Конечную температуру примем по значению для явно преобладающего компонента азота с округлением до десятков при расширении в большую сторону t 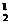 = 2300 С, учитывая, что конечные температуры для других раздельном расширении были бы выше.
= 2300 С, учитывая, что конечные температуры для других раздельном расширении были бы выше.
Определим изменение мольной энтропии смеси с помощью таблиц для её компонентов от 500 до 2300 С, с учетом их мольной доли

 S01cм =
S01cм = 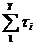 (
( S0 2i -
S0 2i -  S01i) = 13,8 кДж / кмоль·к
S01i) = 13,8 кДж / кмоль·к
Поскольку полученное значение 
 S01cм больше чем
S01cм больше чем  R ln
R ln  , то для процесса расширения второе предварительное значение конечной температуры примем выше на 10°С, т.е. t
, то для процесса расширения второе предварительное значение конечной температуры примем выше на 10°С, т.е. t  = 240°С.
= 240°С.
Тогда изобарное изменение мольной энтропии смеси по таблицам компонентов от 500°С до 240°С

 S011cм = 13,22 кДж / кмоль·к
S011cм = 13,22 кДж / кмоль·к 
 R ln
R ln 
Поскольку значение  R ln
R ln  попало «в вилку» между двумя значениями изменений мольной энтропии
попало «в вилку» между двумя значениями изменений мольной энтропии 
 S0 смеси, интерполируя между температурами 230°С и 240°С, найдем окончательную конечную температуру обратимого адиабатного процесса расширения смеси t2 = 237,4°С. Если бы величина
S0 смеси, интерполируя между температурами 230°С и 240°С, найдем окончательную конечную температуру обратимого адиабатного процесса расширения смеси t2 = 237,4°С. Если бы величина 
 S0cм не попала «в вилку», следовало бы экстраполировать или рассчитать изменение мольной энтропии смеси при температуре еще на 100 С выше.
S0cм не попала «в вилку», следовало бы экстраполировать или рассчитать изменение мольной энтропии смеси при температуре еще на 100 С выше.
Теоретическая работа адиабатного расширения смеси, равная разности мольных энтальпий смеси, найденной по таблицам компонентов при полученной конечной температуре, составит
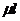 тб =
тб = 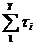 = (
= ( h500 i -
h500 i -  h i237,4) = 8487 кДж / кмоль
h i237,4) = 8487 кДж / кмоль
что на 24 кДж/кмоль больше полученной выше, вследствие примененного неправильного метода расчета.
Правильный метод расчета адиабатного процесса смеси газа по таблицам термодинамических свойств ее компонентов обеспечивает высокую точность расчета, что необходимо при сравнении вариантов.