Процесс оседания частиц дисперсной фазы в жидкой или газовой дисперсионной среде под действием силы тяжести есть седиментация суспензий. По мере увеличения ск-ти оседания возникает сила трения пропор. Ск-ти частицы.Fтр=BU. Частица движется с постоянной скоростью, если сила трения уравновешена силой тяжести. V=2g(p-p0)r2/9η-закон седиментации, условия соблюдения данного закона:
1)Независимость оседания частиц(разб.системы)
2)Ламинарность
3) Дисперсность r=10-7/10-5
4) Сферическая форма частиц
Седиментационный анализ основан на различных скоростях оседания частиц разного размера, с помощью его можно найти средний радиус частицы, описывается ур-ями: m=(Q/H)*Uτ, где Q-общая масса, H-первоначальная высота столба суспензнии m=2Qд(p-p0)r2τ/9ηH, а также уравнением Сведберга-Одена m=qi+(dm/dτ)τ СМОТРЕТЬ ГРАФИК ТЕМА 3.5!!! Дифференциальные кривые распределения показывают распределение масс частиц по их размерам,а функция распределения представляет собой долю частиц в интервале(r+dr)
23. Седиментационно-диффузионное равновесие. Седиментационная устойчивость.
 ,
,  , где -плотность частицы,
, где -плотность частицы,  - плотность дисп.среды,
- плотность дисп.среды,  концентрация частич у дна сосуда, когда h=0,
концентрация частич у дна сосуда, когда h=0,  -концентрация частиц на высоте h от дна сосуда, V-объем частицы. Седим.устойчивость- способность системы протоивостоять действию силы тяжести. Чем больше размеры частицы,тем быстрее скорости оседания частиц.
-концентрация частиц на высоте h от дна сосуда, V-объем частицы. Седим.устойчивость- способность системы протоивостоять действию силы тяжести. Чем больше размеры частицы,тем быстрее скорости оседания частиц.
24. реологические свойства дисперсных систем. Понятия об упругих,вязких и пластических деформациях. Реология – наука о деформации и течении материала. Совокупность механических свойств – прочность, упругость, эластичность, пластичность – является важной характеристикой материала. Поскольку эти свойства связаны со структурой, они называются структурно –механическими. Упругопластические свойства характеризуют способность тел сопротивляться деформациям. Существуют два основных вида деформации: растяжение или сжатие и сдвиг. Деформации бывают упругими – тело полностью восстанавливает свои свойства после снятия нагрузки- и остаточные – без разрушения, возникает под действием тангенциального напряжения. В соответствии с этим тела делятся на упругие и пластичные. Деформации упругих тел описываются законом Гука: P=Е γ. Е – модуль Юнга характеризует жесткость тела. При напряжении большем критического происходит либо разрушение, либо остаточные деформации, характерные для пластичных тел. В этом случае устанавливается течение с постоянной скоростью при постоянном напряжении, отвечающем пределу текучести (прочности). Вязкие тела отличаются от пластических тем, что текут при любых напряжениях. Течение идеально вязких тел описывается законом Ньютона.
P=ηdU/dx.
В основе пластических деформаций – необратимые перемещения атомов на значительные расстояния от исходных положений равновесия. Закон течения в области разрушения структуры описывается уравнением Бингама.
25. Основные законы реологии. Классификация дисперсных систем по структуре и структурно-механическим свойствам. Все реальные тела принято делить на жидкообразные, текущие при любых напряжениях, и твердообразные. Жидкообразные тела классифицируют на:
1) ньютоновские жидкости – системы, течение которых подчиняется закону Ньютона:
P = ŋ 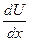 , P – напряжение сдвига, ŋ- коэффициент вязкости,
, P – напряжение сдвига, ŋ- коэффициент вязкости, 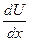 - градиент скорости.
- градиент скорости.
2) неньютоновские жидкости – их вязкость зависит как от T, так и от напряжения сдвига. Они подразделяются а стационарные, реологические свойства которых не изменяются со временем, и нестационарные, для которых эти характеристики зависят от времени. Наиболее общим уравнением, описывающим течение стационарных неньютоновских жидкостей, является эмпирическое уравнение Оствальда-Вейля:  , где k и n – постоянные, данную жидкообразную систему. Если n=1, жидкость является ньютоновской, и константа k совпадает с ньютоновской вязкостью ŋ. При n<1 вязкость растет с увеличением скорости сдвига и напряжения. Эти жидкости наз-ся дилатантными.
, где k и n – постоянные, данную жидкообразную систему. Если n=1, жидкость является ньютоновской, и константа k совпадает с ньютоновской вязкостью ŋ. При n<1 вязкость растет с увеличением скорости сдвига и напряжения. Эти жидкости наз-ся дилатантными. 

а-для жидкообразных тел
б- для твердообразных
Разбавленные грегативно-устойчивые ДС со сферическими частицами обычно представляют собой ньютоновские ж-ти.
ур-е Эйнштейна:
ŋ= ŋ0(1+α φ)
α- коэффициент формы частицы
φ- объемная концентрация дисп.фазы
Согласно теории структурирования все структуры в коллоидных системах делаятся на:
-коагуляционные (за счет ван-дер-ваальсовых сил притяжения частиц)
-конденсационно-кристализационные(хим взаимодействие между частицами и их срастание)
26. Реологические свойства структурированных жидкообразных и твердообразных систем. Вязкость агрегативно устойчивых дисперсных систем.
Реологические свойства структурированных жидкообразных выражаются графиком(тема 4.3.2),а также тиксотропией-самопроизвольным восстановлением стурктуры после разрушения и реолексией- восстановлением структуры после низких нагрузок(смотри график в той же теме!)
Реологические свойства структурированных твердообразных систем: твердые системы делятся на бенгамовские и небенгамовские системы
Бенгамовские
N<1, псевдопластич. Твердобраз.тело
N>1 дилант. Твердобраз тело
Смотри графики 2 штуки тема 4.3.3!!! У твердых тел увеличение напряжения сдвига разрушает тело
Вязкость агрегативно устойчивых дисперсных систем характеризуется ур-ем Эйнштейна: η=η0(1+dфи0), условия применимости ур-я Эйнштейна:
1.Сферич форма частиц
2. Разбавл. И устойч. Дисп система
3.Ламинарный характер течения
И Тут еще 2 графика! Конец Темы 4.3.1
Наличие адсорбционных слоев и ДЭС, взаимодействие частиц дисперсной фазы и их несимметричность-это условия неприменимости ур-я Эйнштейна
27 Агрегативная устойчивость дисп сист.Факторы агрег устойчив:
1ТД факторы(уменьш s):а)электростатический(ДЭС) связан с образ ДЭС (уменьш s) и возникновением потенц барьера отталкивания.б)адсорб-сольватный - уменьш s из-за взаимод частиц с растворителем. Пов-ть частиц лиофильна по своей природе или из-за адсорбции стабилиз неэлектролитов.Для эмульсий-порошки.
в)энтропийный-большую роль играет в высокодисперсных сист ¯SÞU
2Кинетич факторы (¯Vкоагуляции):а)структурно-меж-возник при адсорбции ПАВ и ВМС на пов-ти частиц, что приводит к образ слоев,облад высокими структ-мех св-вами.Длинноцепочечные ПАВ.б)гидродинамическийфактор-за счет увеличения вязкости среды.
28 Ионный фактор стбилиз ДС.Теория ДЛФО. При сближ одноименных заряженных частиц золей их диф слои перекрыв. Это взаимодейств протек в тонкой прослойке дисперсн среды. Устойчивость лиофобных золей определ особыми св-ми этих слоев. Утончение этого слоя заканчивается либо его разрывом либо достиж некоторой равновесной толщины,которая далее не уменишается. Утончение тонкого слоя происходит путем вытекания из него жидк. Когда жидк слой стан тонким,св-ва жидкости в нем начинают сильно отлич от св-в жидк в V.В слое возник доп давление-расклинивающее. Положит расклинив давление препятств сближ частиц,а отриц-наоборот. Расклин давл-S параметр, учитыв как силу притяж, так и силу отталкивания между частицами дисперс фазы.1Электростатич силы взаимод: а)силы оттралкивания 

 ,Еотт¯ àZ,Cпротивоинов; ¯j0, ¯z. б)Ванд-Вальдовские притяж,Е(h), Eкин=кТ. Состояние колл сист зав-т от б
,Еотт¯ àZ,Cпротивоинов; ¯j0, ¯z. б)Ванд-Вальдовские притяж,Е(h), Eкин=кТ. Состояние колл сист зав-т от б  аланса энергии притяж и Еотт. Прео
аланса энергии притяж и Еотт. Прео  блад Еотт приводит к устойчивости сист, преоблад Епритяж вызывает коагуляцию. Частицы дисперс фазы облад опред Екин, зав-т от Т, ха счет котор они могут сближаться. Екин=кТ. В зав-ти от соотнош Ебар и глубины потенц минимумов возможны след сост-иядисп сист,а именно:1 Ебар>>кТ, Емин2<<кТ- неглубокийàcистем агрегативно устойчивая.2 Еб~Емин2£кТàброун движ может сблизить частицы до таких размеров, что они попадут в первичн потенц мин, возможна коагуляция.3 при умеренно глуб вторичн мин Емин2>>кТ, Еб ~5-10кТàвозник дальнее взаимод,образ флуокулы, возможно структурообраз.
блад Еотт приводит к устойчивости сист, преоблад Епритяж вызывает коагуляцию. Частицы дисперс фазы облад опред Екин, зав-т от Т, ха счет котор они могут сближаться. Екин=кТ. В зав-ти от соотнош Ебар и глубины потенц минимумов возможны след сост-иядисп сист,а именно:1 Ебар>>кТ, Емин2<<кТ- неглубокийàcистем агрегативно устойчивая.2 Еб~Емин2£кТàброун движ может сблизить частицы до таких размеров, что они попадут в первичн потенц мин, возможна коагуляция.3 при умеренно глуб вторичн мин Емин2>>кТ, Еб ~5-10кТàвозник дальнее взаимод,образ флуокулы, возможно структурообраз.
 29. Электрокинетические свойства дисперсных систем. Механизм образования ДЭС. Строение ДЭС. Примеры образования ДЭС. Электрокинетические явления. Прямые: - электрофорез(перемещение дисперсной фазы под действием внешн.электрич.поля) – электроосмос (перенос дисп.среды через неподвижн.капиляр –пористую перегородку под действием внешн.электрич поля). Обратные – потениальное оседание,потенциальное течение.Явл. основаны на ДЭС на границе ТВ. И жидк.фаз. Механизм образования. Возникает из-за пространственного разделения зарядов, которые могут возникать разными путями.1)поверхностная ионизация(переход ионов из одной фазы в другую)2)ионизация молекул в-ва ТВ. Фазы за счет диссоциации поверхностных функциональных групп 3)адсорбция ионов (молекул)а)не входящих в кристалл.решетку: органич ионн;с большой адсорбционной способностью б)избирательная ад-ция по правилу Панета-Фаенса 4)поляризация поверхности за счет внешн Эл.поля. Строение. На поверхности частиц дисперсной фазы врзникае заряд из-за ад-ции потенциал. – определ ионов, или поверхн.ионизации цепи.Величина и знак полного термодин потенциала φ0 на поверхности частицы зависит от колва и знака адс-ныхх ионов, этот потенциал притяг противоположно заряж ионы раствора, часть из них сразу примыкает к заряж.поверхности, частично ослабляя ее заряд -> адсорбционный слой.Его можно считать плоск. Конденсатором, в котором потенц смягчается линейно.Др.часть противоионов под действ теплового движения распространяется в глубь фазы,обазуя диф.слой.Ионы там распред.неравномерно-потенц.смягчается по экспоненте.
29. Электрокинетические свойства дисперсных систем. Механизм образования ДЭС. Строение ДЭС. Примеры образования ДЭС. Электрокинетические явления. Прямые: - электрофорез(перемещение дисперсной фазы под действием внешн.электрич.поля) – электроосмос (перенос дисп.среды через неподвижн.капиляр –пористую перегородку под действием внешн.электрич поля). Обратные – потениальное оседание,потенциальное течение.Явл. основаны на ДЭС на границе ТВ. И жидк.фаз. Механизм образования. Возникает из-за пространственного разделения зарядов, которые могут возникать разными путями.1)поверхностная ионизация(переход ионов из одной фазы в другую)2)ионизация молекул в-ва ТВ. Фазы за счет диссоциации поверхностных функциональных групп 3)адсорбция ионов (молекул)а)не входящих в кристалл.решетку: органич ионн;с большой адсорбционной способностью б)избирательная ад-ция по правилу Панета-Фаенса 4)поляризация поверхности за счет внешн Эл.поля. Строение. На поверхности частиц дисперсной фазы врзникае заряд из-за ад-ции потенциал. – определ ионов, или поверхн.ионизации цепи.Величина и знак полного термодин потенциала φ0 на поверхности частицы зависит от колва и знака адс-ныхх ионов, этот потенциал притяг противоположно заряж ионы раствора, часть из них сразу примыкает к заряж.поверхности, частично ослабляя ее заряд -> адсорбционный слой.Его можно считать плоск. Конденсатором, в котором потенц смягчается линейно.Др.часть противоионов под действ теплового движения распространяется в глубь фазы,обазуя диф.слой.Ионы там распред.неравномерно-потенц.смягчается по экспоненте.  За толщ. Диф. Слоя принято считать расстояниена кот потенциал φ0 уменьшится в е раз.
За толщ. Диф. Слоя принято считать расстояниена кот потенциал φ0 уменьшится в е раз. 
30Электрокинетич потенциал.Влияние разл факторов на вел электрокин потенциала.
Дзета потенциал-важнейшая характеристика ДЭС,котор опред скор перемещ частиц,для фазы и дисперсн среды и устойчивость золей.1Влияение индиф ионов-индиф ионы не влияют на j0.а)ионы,сходн с противоионами ДЭС:С=d¯Þz¯(изоэлектрич состояние)  б)специф адсорбир противоионы,вызыв перезаряд плотной части.2)влиян неиндиф ионов:а)заряд ионов совпад со знаком j0.С увелич концентр ионов дзета потенц возрастает засчет увелич j0потенц,при дальн увелич конц ионов дзета-потенц уменьш из-за сжатия диффуз слоя до изоэлектр состояния.б)заряд ионов противополож j0.Добавл таких ионов ведет к полной перестройке ДЭС, j уменьш до 0 и даже перезарядки поверх частицы.3)Влияние тем-ры:с увелич Т увеличdÞz(с увелич тем-ры часть противоинов перех из адсорб слоя в дифф.При дальнейшем процессы десорбции захват более глуб обл ДЭС,часть потенц опред ионов перех в р-р j0¯,z¯.ТÞj0¯Þz¯.(нарисовать рисунки))).
б)специф адсорбир противоионы,вызыв перезаряд плотной части.2)влиян неиндиф ионов:а)заряд ионов совпад со знаком j0.С увелич концентр ионов дзета потенц возрастает засчет увелич j0потенц,при дальн увелич конц ионов дзета-потенц уменьш из-за сжатия диффуз слоя до изоэлектр состояния.б)заряд ионов противополож j0.Добавл таких ионов ведет к полной перестройке ДЭС, j уменьш до 0 и даже перезарядки поверх частицы.3)Влияние тем-ры:с увелич Т увеличdÞz(с увелич тем-ры часть противоинов перех из адсорб слоя в дифф.При дальнейшем процессы десорбции захват более глуб обл ДЭС,часть потенц опред ионов перех в р-р j0¯,z¯.ТÞj0¯Þz¯.(нарисовать рисунки))).
31. Коагуляция дисперсных систем. Факторы, влияющие на электролитную коагуляцию дисперсных систем. Быстрая и медленная коагуляция.
Коаг-я – процесс слипания частиц с обр-ем крупных агрегатов. В р-те коаг.сист.теряет седиментац-ю устойч-ть,т.к. частицы стан-ся слишком круп-ми и не могут уч-ть в броун.дв-и. 2 стадии: 1. срытая к-я: частицы укрупняются, но не терю сед.уст-ти; 2. явная: ч.тер.сед.уст-ть. если плот-ть ч. Больше пл-ти дисперсионной среды, - осадок. Факторы: изм-е Т, действие электрич и электромагн.полей, д-е видимого света,облуч-е элем-ми част-ми, мех.возд-е, доб-е электролитов.
Быстрая к-я: Смолуховский: 1. рассм. Сист монодисп.; 2. все столкновения эффект-е; 3. рассм-ся только столкн-я первич.частиц; 4. кин-ка коаг.подобна кин-ке бимол-ной р-и –(dv/dt)=kv2, k – const скор-ти коаг. Для х-ки быс.к-и исп период коаг-и θ – время, через кот. концентр-я колл-х ч-ц ум-ся в 2 раза. vt=v0/2 t=θ θ=1/kv0 cогласно теор.быстр.коаг, k зав-т от коэфф.дифф: k=16πDr.
Медл.к-я: связ. с неполной эфф-ю столкн-я вследствие сущ-я энерг.барьера. Фукс. kкм=kкб*Р*е^(-ΔUк/kt), kкм – конст.скор медл.коаг; kкб- //-// быстрой к-и, Р – стерич.фактор, ΔUк – потенц.барьер к-и, k – пост.Больцмана=R/Na.
32. Коагуляция д.систем. нейтрализационная и концентрационная к. К.смесью электролитов. Защита коллоидных частиц.
Устойчивость д.системы характеризуется неизменностью во времени ее основных параметров: дисперсности и равновесного распределения дисперсной фазы в среде. Коагуляция – процесс слипания частиц, образования более крупных агрегатов с потерей седиментационной и фазовой устойчивости и последующим разделением фаз – разрушением дисперсной системы.
При Еб<=кТ наступает коагуляция. Все без исключения электролиты вызывают коагуляцию при увеличении концентрации их в растворе до некоторого критического значения Ск, называемого порогом коагуляции. Обратная величина называется коагулирующей способностью. Коагуляцию вызывают противоионы. Увеличение концентрации ведет к уменьшению толщины диффузного слоя и понижению ζ-потенциала. Коаг.способность ионов зависит от радиуса иона. чем больше радиус иона тем меньше он в гидротированном состоянии (гидротир.радиус), тем выше адсорбционная способность иона, а следовательно при меньших концентрациях укомплектовыва-
ется адсорбц.слой и вызывается коагуляция. В гомологич.рядах электролитов с органич.ионами коагул.способность увеличивается с удлинением радивала в соответствии с правилом Траубе, заключающее-
ся в том, что поверхностная активность увеличивается в 3-3,5 раза при удлинении углеводород. цепи на СН2. коагулирующая способность ионов зависит от их заряда – правило Шульца-Гарди.: γ=1/zn.
Если в результате введения электролита происходит адсорбция ионов на поверхности частиц и снижается потенциал поверхности до некоторой ритической величины, говрят о нейтрализационной коагулции. Адсорбционной способностью обладают ионы, способные достраивать кристаллическую решетку частиц, или поливалентные ионы, обладающие специфическим адсорбционным потенциалом. (т.е. неиндифферентные ионы: при увеличении С0 φ0 и ζ уменьшаются). Процесс концентрационной коагуляции заключается в том, что в присутствии электролита сжимается диффузная обкладка двойного электрического слоя, но потенциал поверхности частиц остается неизменным (т.е. индифферентные ионы).
Коллоидная защита: повышение агрегативной устойчивости лиофобных золей, увеличение порога и неподчинение правилу Шульца-Гарди – белков, углеводов и ПАВ. Количественно выражается защитным числом МГ сухого вещества, которое защищает 10 мл золя при добавлении к нему 1 мл 10 % раствора NaCl. Механизм защиты: макромолекулы адсорбируются на поверхности частиц, создавая адсорбционные сольватные слои, которые повышают лиофильность коллоидных частиц, они обеспечивают большое расклинивающее давление при сближении двух частиц. Такой принцип: получение золей серебра, белки крови защищают капельки холестерина.
33. Классификация и общая характеристика ПАВ. Свойства коллоидных ПАВ. Числа ГЛБ. Применение ПАВ.
ПАВ – это вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз. При этом во всем интервале концентраций вплоть до насыщенного раствора ПАВ находятся в молекулярно-дисперсном состоянии, т.е. системы являются гомогенными. Отличие коллоидных ПАВ от обычных заключается только в длине углеводородного радикала.
Свойства ПАВ:
1) Способность значительно снижать поверхностное натяжение на границе раздела фаз.
2) Самопроизвольное мицеллообразование.
3) Солюбилизация (растворение в мицеллах ПАВ нерастворимых в дисперсионной среде в-в)Классификация коллоидных ПАВ:
1) По растворимости:
а) водорастворимые;
б) жирорастворимые.
2) По взаимодействию с растворителем:
а) истиннорастворимы;
б) коллоидные ПАВ.
3) По степени диссоциации:
− Ионногенные:
1. Катионные ПАВ (поверхностно-активный катион):
а) соли аминов;
б) соли аммониевых оснований;
в) алкилпиридиновые основания. Наиболее токсичные.
2. Анионные ПАВ:
а) карбоновые кислоты и их соли. Используются как моющие средства, но не в кислых или солевых растворах.
б) алкилсульфаты;
в) алкиларилсульфонаты.
Соли сильных кислот могут быть и в кислых и в солевых растворах.
3. Амфолитные ПАВ. Содержат 2 функциональные группы. Одна имеет кислотный характер, другой основный характер.
−Неионогенные. В растворах не распадаются на ионы. Обладают хорошим моющим действием. Свойства можно регулировать, изменяя длину цепочки, которая определяет гидрофильные свойства. Разлагается биологически.
ГЛБ – гидрофильно-липофильный баланс. Числа ГЛБ характеризуют соотношение между гидрофильными и гидрофобными свойствами: чем выше число ГЛБ, тем больше баланс сдвинут в сторону гидрофильных (полярных) свойств ПАВ. Групповые числа гидрофильных групп – положительны, гидрофобных групп – отрицательны.
Применение ПАВ:
1) ПАВ – основа синтетических моющих средств – детергентов.
2) ПАВ входят в состав смазочных жидкостей.
3) ПАВ – стабилизаторы микрогетерогенных систем: суспензий, эмульсий, пен, порошков.
4) Мицеллярный катализ, т.е. проведение различных реакций, в растворе ПАВ выше ККМ.
5) Высококонцентрированные растворы некоторых ПАВ формируют упорядоченные структуры – жидкие кристаллы, широко используемые в современной технике.
6) ПАВ применяются в пищевой промышленности.
34. Строение мицелл ПАВ. Механизм термодинамика мицеллообразования. Солюбилизация.
Мицеллообразование, самопроизвольная ассоциация молекул ПАВ в р-ре. В результате в системе ПАВ-р-ри-тель возникают м и ц е л л ы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. В т.наз. прямых мицеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу. Число молекул ПАВ, образующих мицеллу, наз. числом агрегации; по аналогии с мол. массой мицеллы характеризуются и т. наз. мицелляр-ной массой. Обычно числа агрегациит составляют 50-100, мицеллярные массы равны 103-105. Образующиеся при мицеллообразовании мицеллы полидисперсные и характеризуются распределением по размерам или числам агрегации.
Мицеллообразование характерно для разл. видов ПАВ-ионогенных (анион-и катионактивных), амфолитных и неионогенных и обладает рядом общих закономерностей, однако оно связано и с особенностями строения молекул ПАВ (размер неполярного радикала, природа полярной группы), так что правильнее говорить о мицеллообразовании данного класса ПАВ.
Мицеллообразование происходит в определенном для каждого ПАВ интервале т-р.
Одним из наиболее характерных свойств мицеллярных растворов ПАВ можно считать их способность растворять нерастворимые в воде вещества. Такое свойство по предложению Мак-Бена получило название «солюбилизация». Поскольку солюбилизация может проявляться не только в водных, но и в неводных растворах, то по определению Мак-Бена, данному им в 1948 г., солюбилизация – это растворение под действием ПАВ нерастворимых в данной жидкости веществ. Процесс солюбилизации можно рассматривать как распределение труднорастворимого вещества между истинным раствором и мицеллами ПАВ. Очевидно, что абсолютно нерастворимые вещества не будут и солюбилизироваться, так как их переход от частиц или капель в мицеллы должен происходить через молекулярный раствор.
35Влиян разл факторов на ККМ.Методы опред ККМ. Факторы: 1)длина УВ-радикала(Для Н2О=R,тем ¯ККМ.,для др R=ККМ),для соседних гомологов отнош ККМ~3,2.2)полярная группа.RTlnKKM=a-bn,а-пост,характ энерг растворения функц групп полярных частей. B-пост,характ энерг растворения,приход на 1 гр СН2.При равном R то в-во имеет большую ККМ,у котор лучше дмссоц его полярная гр.3)Влияние добавок электролитови пол орг в-во. В р-ра ионогенных ПАВ с эл-та вызывает ККМ.Повыш мицелообраз объясн сжатием дифф слоя под давл диссоц ионов ПАВи часть дегидротац ионов ПАВнизкомолек соед. С высомолек дисп соедàККМ¯.4)влияние тем-ры:НПАВусил тепл движ и препятствует агрегации àККМ.Методы основ на регистр разного измен физ-хим св-вр-рав ПАВ в зав-ти от С.
36. Порошки, аэрозоли. Методы получения. Стабилизация и разрушение аэрозолей. Основные свойства этих дисперсных систем. Практическое значение порошков и аэрозолей. Аэрозоль- микрогетерогенная система, в которой частички твердого вещества или капельки жидкости взвешены в газе.Туман,дым,пыль,смог.Пролучают из грубодисперсных и и истинных растворов. Конденсационно:1-адиобатическое расширение газа 2-смешение газов и паров,имеющих разные температуры 3-охлаждение газовой смеси,содержащей пар 4 – врезультате хим.реакций сгорания топлива,фосфора, окисления металлов металлургических процессах.Диспергационные – приизмельчении,распылении твердых и жидких тел в газовой среде и при переходе порошковообразных веществ во взвешенное состояниепод действ.воздушн.потоков. Верхний предел размеров не определен, но не крупнее 100мкм.Частицы могут существовать сами по себе или объединяться в цепочки-флокулы.Имея малые размеры,обладают развитой поверхностью,на которой протекает адсорбция,горение и т п,обуславливает также гигроскопичность и взаимодействие с электрич зарядами.Рассеяние и поглощение света., малая концентрация частиц дисп фазы,малая вязкость и плотность дисп среды. Не возникае ДЭс,заряд частиц носит случ хар-тер,изменяется во времени по величине и знакук,очень мал,,агрегативная неустоичивость. Применяются в различн областях техники, в с\х,здравоохр.,быту
37.Суспензии. Методы получения. Агрегативная и седиментационная устойчивость разбавленных суспензий. Основные свойства суспензий. Способы разрушения разбавленных суспензий. Области применения.
Суспензии-это дисп.системы, в к-рой дисп.фазой явл. частицы твердого в-ва размером >10-5см, дисп.средой – жидкость. Методы пол-ния: со стороны грубодисперст.систем – диспергацион., со стороны ист.р-ров – конденсационные. Седим.устойчивость- способность системы протоивостоять действию силы тяжести. Агрегат.устойчивость – способность сохранять неизменной во времени степень дисперстности. Свойства: 1) молекулярно-кинетич(диаметр 10-5-10-2, дифузионно-седиментац.устойчивость);2) оптич(длины волн видимой части спектра лежат в пределах от 4*10-5см(фиолетовый свет) до 7*10-5см(красный),3)электрокинемат(образование на пов-ти ДЭС и возник-ие электрокинемат.потенциала.
Способы разрушения: 1)механич.(отделение в-ва дисп.фазы от дисп.среды, благодаря седимент.неустойчивости суспензий),2)термич(изменеие тем-ры суспензий),3)химич. (исп.химич.реагенты),4)электрич(исп.,когда частицы в суспензиях стабилизированы ионогенными в-вами).
38. Лиозоли. Методы получения. Особенности стабилизации и коагуляции лиозолей. Особые свойства. Практическое применение.Общие усорвия получения-нерастворимость или очень малая растворимость вещества дисперсно фазы в дисп среде и наличие стабилизаторов.Диспергацион.методы получения:механическое измельчение,в коллоидных мельницах,диспергирование ультрозвуком,электрическое диспергирование.Концентрационные методы – пресыщенность исходной системы,конденсация из паров,иметод замены растворителя,химическая концентрация.Под устойчивостью понимают постоянство во времени дисперстности и распределения частиц дисперсной фазы по объему дисперсной среды. Коагуляция – нарушения агрегативной устойчивости (слипание, выпадение в осадок). Факторы агрегативной устойчивости – а)электростатический,возникают электростатич силы ооталкиванием с ростом дзета потенц.а)кин. Структурно-механич фактор возникает при адсорбции пав б)адсорбционно-сольватный.поверхн частиц лиофильна б)кин. Гидродинамический возникает при росте вязкости скорость и кин энергия малы, в)энтропийный любая сисма стремится к стабилизации. Ионный фактор – перекрывание диффузных слоев. Бывает скрытая коагуляция и явная. Ее вызывает 1)любой электролит, если его концентрация привышает критическую.Порог коагуляции – этто мин колво электролита,вызывающая коагуляция 1л золя. 2)противоионы 3) коаг способность ионов зависит от радиуса иона и заряда. Св-ва:1)умень поверхн натяж на границе фаз 2)мицеллообразование 3)солюбилизация-раств в мицеллах ПАВ нерастворимых в дисперсной среде в-в