Теоретическая часть
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Химическая термодинамика изучает превращение энергии химических реакций в другие виды – тепловую, электрическую, лучевую и т.д.
Химические процессы, протекающие с выделением тепла (Q) – экзотермические, а с поглощением тепла (- Q) – эндотермические. Согласно первому закону термодинамики, сообщенная системе теплота (Q) расходуется на приращение внутренней энергии (D U) и совершение работы (А) против сил внешнего давления (А = р D V):
 ; (3.1)
; (3.1)
 (3.2)
(3.2)
Для изобарных систем (р = const) тепловой эффект при постоянном давлении (Qp) проявляется как изменение энтальпии (D H), и первый закон записывается как
 (3.3)
(3.3)
БЛОК-СХЕМА РАЗДЕЛА
| I | II | III |
| Характеристические термодинамические условия Р = const (изобарный) V = const (изохорный) Т = const(изотермический) Q = 0 (адиабатический) f(P,T,V) = 0 – универсальное уравнение состояния системы | Термодинамические функции D U – внутренняя энергия (– Qv) D H – энтальпия (– Qp) S = K .ln W, W – вероятность существования процесса K = R/NA; S = D H/T (энтропия) D G = –Ар; D F = – Аv D G – энергия Гиббса D F– энергия Гельмгольца А – работа (p D V) (Ар – работа при Р = const) (Аv – работа при V = const) NA – число Авогадро | Взаимосвязь термодинамических
параметров
Q =D U+A (I закон термодинамики)
Р =const D H =D U + p D V
V =const D U=QV
D T =0 QT=A; А = p D V
Q =0 D U= -A
D S > 0 (II закон термодинамики)
D G =D H-T D S, D F =D U - T D S
по закону Гесса
D H х.р.= Su1D H  (прод) –
– Su2D H (прод) –
– Su2D H  (исх.в-в).
D S х.р.и D G х.р. аналогично
T ®0 D G » D H (III з-н термодинамики) (исх.в-в).
D S х.р.и D G х.р. аналогично
T ®0 D G » D H (III з-н термодинамики)
|
| IVХимическое равновесие D G = 0, D S = 0 | ||
| процесс идет самопроизвольно: D G < 0, D S > 0 | ||
| Сдвиг равновесия а) При увеличении Т равновесие смещается в сторону эндотермической реакции; б) При увеличении Р равновесие смещается в сторону меньших объемов; в) При увеличении концентрации одного из веществ равновесие смещается в сторону той реакции, которая уменьшает концентрацию этого вещества |
«ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА»
Химические уравнения с приведенными тепловыми эффектами Q и D H и агрегатными состояниями веществ называются термохимическими. Согласно основному закону термохимии (Гесс, 1836 г.), тепловой эффект химических реакций не зависит от промежуточных стадий процесса, а определяется лишь начальным и конечным положением системы. Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ с учетом стехиометрических коэффициентов перед формулами:
а А + b B ® c C + d D +  ; (3.4)
; (3.4)
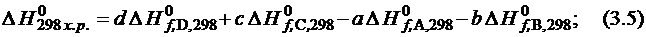
 . (3.6)
. (3.6)
Стандартная теплота образования D H  кДж/моль – теплота, выделяемая или поглощаемая системой при образовании 1 моль вещества из простых веществ, взятых в устойчивых состояниях при стандартных условиях (Т = 298 К; Р = 101 кПа).
кДж/моль – теплота, выделяемая или поглощаемая системой при образовании 1 моль вещества из простых веществ, взятых в устойчивых состояниях при стандартных условиях (Т = 298 К; Р = 101 кПа).
Записывая термохимическую реакцию, необходимо учитывать в скобках агрегатное состояние вещества и условия процесса. Для реакции нейтрализации тепловой эффект, который необходимо будет экспериментально определить, можно найти теоретически:
NaOH(ж) + HCl(ж) ® NaCl(ж) + H2O(ж) + D H  нейтр; (3.7)
нейтр; (3.7)
D H  нейтр=
нейтр=  +
+  –
– 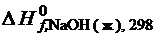 –
–
–  . (3.8)
. (3.8)
Сокращенно реакцию нейтрализации можно изобразить ионным уравнением
H+(ж) + OH-(ж) = H2O + D H  нейтр.; (3.9)
нейтр.; (3.9)
D H  нейтр.=
нейтр.=  –
–  –
–  . (3.10)
. (3.10)
Таким образом, независимо от природы кислоты, D H  нейтр. должна иметь постоянное значение, равное –55,8 кДж/моль.
нейтр. должна иметь постоянное значение, равное –55,8 кДж/моль.
Для реакции нейтрализации слабых электролитов или концентрированных растворов реакция сопровождается дополнительной диссоциацией ионов слабого электролита, поэтому D H  нейтр. несколько отлична от –55,8 кДж/моль.
нейтр. несколько отлична от –55,8 кДж/моль.
Определение возможности и предела самопроизвольного протекания реакций. Согласно второму закону термодинамики, позволяющему определять предел и возможность протекания химических процессов, самопроизвольно протекают процессы, при которых энергия Гиббса (D G) или энергия Гельмгольца (D F) меньше нуля. Энергия Гиббса и энергия Гельмгольца связаны с энтропийным (D S) и энтальпийным (D H) факторами:
 (3.11)
(3.11)
 (3.12)
(3.12)
S = K . ln W, (3.13)
где W – вероятность существования процесса.
Энтропия – логарифмическая функция термодинамической вероятности системы, определяющая меру беспорядка в системе.
В изолированной системе самопроизвольно протекают процессы в сторону увеличения беспорядка в системе. Если D S > 0, то самопроизвольное протекание процесса термодинамически возможно, если D S < 0, самопроизвольно процесс не может протекать. Знак минус перед членом T Δ S стоит потому, что для самопроизвольного процесса без изменений Δ Н Δ S является положительной величиной.
Если в процессе энтропия не изменяется (Δ S = 0), то фактором, определяющим направление реакции, будет изменение энтальпии. Уменьшение энтальпии (Δ Н < 0) соответствует уменьшению энергии Гиббса (Δ G < 0) и в этом случае самопроизвольно протекает реакция с выделением тепла (Q > 0) и уменьшением энтальпии (Δ Н < 0).
Если же энергия системы постоянна и изменения энтальпии в процессе не происходит (Δ Н = 0), то система самопроизвольно может перейти только в состояние с большей энтропией (Δ S > 0), так как из-за знака минус перед членом T Δ S изменение изобарного потенциала будет отрицательной величиной (Δ G < 0).
Возможность самопроизвольного протекания процесса определяется по знаку функции свободной энергии. Если D G < 0, то в процессе взаимодействия происходит уменьшение свободной энергии и термодинамически возможно самопроизвольное протекание процесса. Если D G > 0, самопроизвольное протекание процесса невозможно. Величины D G, D F, D S, D H вычисляются по закону Гесса
 . (3.14)
. (3.14)