1. Как изменяется температура некоторой массы идеального газа, который расширяется по закону pV = const?
2. Начертите изохору идеального газа в координатах TV, ТР, РV
3. Начертите изобару идеального газа в координатах TV, ТР, РV.
4. Начертите изотерму идеального газа в координатах TV, ТР, РV.
5. Как зависит давление идеального газа от его массы при постоянных объёме и температуре?
 прямо пропорционально.
прямо пропорционально.
6. Как зависит масса идеального газа от давления при постоянных температуре и объёме?
 прямо пропорционально.
прямо пропорционально.
7. Как зависит масса идеального газа от объема при постоянных температуре и давлении?
Ответ:
 Исходя из этой формулы, при постоянных T и p, m зависит от V прямо пропорционально.
Исходя из этой формулы, при постоянных T и p, m зависит от V прямо пропорционально.
8. Как зависит объём идеального газа от его молекулярной массы, если давление, масса и температура газа поддерживаются постоянными?
Ответ:
 . Формула та же, логика то же. V зависит от M обратно пропорционально.
. Формула та же, логика то же. V зависит от M обратно пропорционально.
9. Как зависит давление идеального газа от его молекулярной массы, если объём, масса и температура газа поддерживаются постоянными?
 Формула та же, логика то же. p зависит от M обратно пропорционально.
Формула та же, логика то же. p зависит от M обратно пропорционально.
10. Какая зависимость между средней кинетической энергией поступательного движения молекул газа и абсолютной температурой?
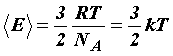 Вот формула зависимости. Еще надо знать вот это: Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
Вот формула зависимости. Еще надо знать вот это: Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
11. Как зависит температура идеального газа от его молекулярной массы, если давление, масса газа и его объём поддерживаются постоянными?
Ответ:
 Формула та же, логика то же. Зависимость T от M обратно пропорциональная.
Формула та же, логика то же. Зависимость T от M обратно пропорциональная.
12. Как зависит давление газа от средней скорости поступательного движения молекул?
 Давление возрастает при возрастании скорости.
Давление возрастает при возрастании скорости.
13. Как зависит коэффициент диффузии от средней скорости поступательного движения молекул?
 Прямо пропорционально.
Прямо пропорционально.
14. Как изменяется внутренняя энергия идеального газа при изотермическом расширении?
 , т.е. не изменяется, т.к. температура постоянна.
, т.е. не изменяется, т.к. температура постоянна.
15. Как изменяется внутренняя энергия идеального газа при изобарическом сжатии?
 , При сжатии, для сохранения постоянного давления необходимо охлаждать газ. Соответственно энергия уменьшается, т.к. зависимость U от T прямо пропорциональна.
, При сжатии, для сохранения постоянного давления необходимо охлаждать газ. Соответственно энергия уменьшается, т.к. зависимость U от T прямо пропорциональна.
16. Как зависит внутренняя энергия идеального одноатомного газа от его объёма?
не зависит.
17. Как изменяется внутренняя энергия идеального газа при изобарическом расширении?
 , При расширении, для сохранения постоянного давления необходимо нагревать газ. Соответственно энергия увеличивается, т.к. зависимость U от T прямо пропорциональна.
, При расширении, для сохранения постоянного давления необходимо нагревать газ. Соответственно энергия увеличивается, т.к. зависимость U от T прямо пропорциональна.
18. Чему равна теплоемкость трехатомного газа при постоянном давлении?

19. Чему равна теплоёмкость 1 моля идеального одноатомного газа при изотермическом процессе?
Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими. Все изопроцессы являются политропическими. В случае изотермического процесса Δ T = 0, поэтому CT = ∞.
20. Чему равна теплоёмкость 1 моля идеального одноатомного газа при изобарическом процессе?
Молярная теплоёмкость при постоянном давлении обозначается как 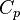 . В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера  .
.
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной:
· для одноатомных газов  , то есть около 20.8 Дж/(моль·К);
, то есть около 20.8 Дж/(моль·К);
21. Какая зависимость между теплоемкостью газа и числом степеней свободы при постоянном объеме?

22. Определить теплоемкость двухатомного газа при постоянном давлении.
для двухатомных газов  , то есть около 29.1 Дж/(моль·К);
, то есть около 29.1 Дж/(моль·К);
23. Получите выражение для работы идеального газа при изотермическом процессе.
Исходная формула - уравнение I начала термодинамики Q = Δ U + A.
Изотермический процесс – это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром, T = const.
На плоскости (P, V) изотермические процессы в случае идеального газа при различных значениях температуры T изображаются семейством гипербол  (закон Бойля–Мариотта). Для одного моля идеального газа:
(закон Бойля–Мариотта). Для одного моля идеального газа:
| PV = const = RT, |
где R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная.
Так как внутренняя энергия идеального газа зависит только от температуры (закон Джоуля), то первый закон термодинамики для изотермического процесса записывается в виде:
| Q = A. |
24. Получите выражение для работы идеального газа при адиабатическом процессе.
Работа в термодинамическом процессе  , таким образом, выражается так:
, таким образом, выражается так:
 .
.
Величина работы зависит от пути, по которому термодинамическая система переходит из состояния  в состояние
в состояние  , и не являетсяфункцией состояния
, и не являетсяфункцией состояния
Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы. Так как передачи теплоты при адиабатическом процессе не происходит, то  и уравнение I начала термодинамики (Q = Δ U + A.) принимает вид
и уравнение I начала термодинамики (Q = Δ U + A.) принимает вид
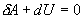
| (9.20) |
или

т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии.
25. За счёт чего идеальный газ при адиабатическом расширении выполняет работу?
При адиабатическом процессе внешняя работа газа может производиться вследствие изменения его внутренней энергии. Адиабатное расширение газа (dV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (dT<0).