Пример 1. Известны тепловые эффекты следующих реакций (1) и (2) при 273 К и постоянном давлении 101,3 кПа. Рассчитать при тех же условиях тепловой эффект реакции (3).
(1) 
 =
= 
(2) 


(3) 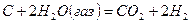
 =?
=?
Решение. Для определение теплового эффекта реакции воспользуемся следствием 1 закона Гесса. Термохимическое уравнение реакции (3) можно получить в результате следующей комбинации термохимических уравнений реакций (1) и (2): (3) =(1) – 2×(2)


Следовательно:  ;
;
 кДж.
кДж.
Пример 2. Вычислите тепловой эффект образования NH3 из простых веществ при стандартном состоянии по тепловым эффектам реакций:
(1) 2Н2 + О2 = 2Н2О(ж),  = -571,68 кДж
= -571,68 кДж
(2) 4NH3 + 3O2 = 6Н2О(ж) + 2N2, 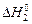 = -1530,28 кДж
= -1530,28 кДж
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить:
(3) ½ N2 + 3/2 Н2 =NH3, DfH0(NH3) =?
В уравнения (1) и (2) входят Н2O(ж) и О2, которые не входят в уравнение (3). Поэтому, чтобы исключить их из уравнений (1) и (2), умножим уравнение (1) на 3 и вычтем из него уравнение (2):
6Н2 + 3О2 – 4NH3 – 3О2 = 6Н2О(ж) – 6Н2О(ж) – 2N2(г) (4)
После преобразования уравнения (4) и деления его на 4 получаем искомое уравнение (3). Аналогичные действия проведем с тепловыми эффектами ( ×3 –
×3 – 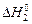 ):4 =
):4 =  .
.
В результате получаем: [-571,68×3-(-1530,28)]:4 = -46,19 кДж,
т.е. DfH0(NH3) = –46,19 кДж/моль.
Пример 3. Вычислите теплоту гидратации СаCl2, если известно, что при растворении 1 моль безводного СаСl2 выделяется 72,7 кДж, а при растворении 1 моль кристаллогидрата CaCl2×6Н2О поглощается 18,0 кДж теплоты.
Решение. Процесс растворения в воде хлорида кальция можно разбить на две стадии:
(1) CaCl2(к) + 6Н2О(ж) = СаСl2×6Н2О(к); 
(2) СаСl2×6Н2О(к) + aq = СаСl2aq(ж) + 6Н2О(ж); 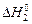 .
.
Первая стадия – процесс гидратации, т.е. получение кристаллогидрата, тепловой эффект которой нужно рассчитать; вторая стадия – растворение кристаллогидрата в воде. Суммарный тепловой эффект 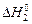 +
+  равен теплоте растворения безводной соли
равен теплоте растворения безводной соли  :
:
СаСl2(к) + aq = СaCl2aq(ж);  .
.
Разность теплот растворения безводной соли ( ) и растворения кристаллогидрата (DН02) представляет собой теплоту гидратации (
) и растворения кристаллогидрата (DН02) представляет собой теплоту гидратации ( ).
).
Подставив соответствующие значения тепловых эффектов, получаем:
DН0гидр. = -72,7 – (+18,0) = -90,7 кДж,
т.е. при гидратации 1 моль CaCl2 выделяется 90,7 кДж теплоты.
Пример 4. Какое из перечисленных соединений HF (г), HCl (г) и HBr (г), находящиеся в стандартном состоянии, является наиболее устойчивым, т.е. будут разлагаться при более высоких температурах.
Решение. Тепловые эффекты реакций, протекающих в прямом и обратном направлениях, равны по величине и противоположны по знаку. Это означает, что если известны стандартные теплоты образования данных соединений, то энтальпии разложения этих соединений будут равны, но противоположны по знаку энтальпии образования. Чем прочнее молекула, тем больше энергии необходимо затратить на ее разложение.
DfH0(HF)= -270,7; DfH0(HCl)= -92,30; DfH0(HBr)=-35,98 (кДж/моль).
Из трех соединений наиболее устойчивым является HF, так как на разложение 1 моль этого соединения потребуется 270,7 кДж теплоты, т.е.
DfН0HF(г) = -DН0разлож.НF(г).
Пример 5. Определите тепловой эффект реакции в стандартных условиях (Т = 298 К).

Решение. Для определение теплового эффекта реакции воспользуемся с ледствием 2 закона Гесса. Стандартные теплоты образования исходных веществ и продукта реакции находим в справочнике:
Вещество  , кДж/моль
, кДж/моль
 -1675,0
-1675,0
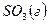 - 395,2
- 395,2
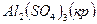 -3434,0
-3434,0
Поскольку в справочнике  приводится в расчете на 1 моль, то при расчете теплового эффекта реакции соответствующее значение
приводится в расчете на 1 моль, то при расчете теплового эффекта реакции соответствующее значение  умножается на число моль вещества, участвующего в реакции.
умножается на число моль вещества, участвующего в реакции.

 - 3434,0 - ( -1675,0) - 3 (-395,2) = -573,4 кДж.
- 3434,0 - ( -1675,0) - 3 (-395,2) = -573,4 кДж.
Данная реакция идет с поглощением теплоты ( >0), т.е. является эндотермической.
>0), т.е. является эндотермической.
Пример 6. По известным значениям тепловых эффектов реакций сгорания алмаза и графита рассчитайте тепловой эффект превращения одного моля углерода в форме алмаза в графит ( =?).
=?).
Решение. Определим энтальпии реакций сгорания графита и алмаза:
(1) Сграфит + О2 = СО2; DН01 = -396,3 кДж/моль,
(2) Салмаз + О2 = СО2; DН02 = -399,197 кДж/моль,
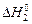 = DfН0(СО2) + (DfH0C(алмаз) + DfH0(O2) = –396,3 – 1,897 – 0 = –398,197 кДж/моль.
= DfН0(СО2) + (DfH0C(алмаз) + DfH0(O2) = –396,3 – 1,897 – 0 = –398,197 кДж/моль.
Чтобы из уравнения (1) и (2) получить уравнение перехода алмаза в графит с неизвестным тепловым эффектом, достаточно из второго вычесть первое:
Салмаз = Сграфит, DН03 =?
и соответственно, DН03 = DН02 - DН01 = -398,197 – (-396,3) = -1,897 кДж/моль.
Пример 7. Сколько теплоты выделится при сжигании 20 литров этилена, взятого при нормальных условиях, если известны стандартные теплоты образования веществ.
Решение. Запишем уравнение процесса горения этилена:
 |
С2Н4(г) + 3О2 = 2СО2(г) + 2Н2О(ж)
Подставив справочные данные, получим:
DНхим.реак.= 2×(-396,3) + 2×(-285,84) – 52,28 = -1130,72 кДж.
Следовательно, при сжигании 1 моль С2Н4 выделяется 1130,72 кДж.
Однако, по условию задачи сжигается 20 л этилена, что составляет
nмоль=  моль, где 22,4 л/моль – мольный объем любого газа при н.у. Таким образом, при сгорании 0,89 моль этилена выделится:
моль, где 22,4 л/моль – мольный объем любого газа при н.у. Таким образом, при сгорании 0,89 моль этилена выделится:
0,89 моль×(-1130,72 кДж/моль) = –1009,57 кДж теплоты.
Пример 8. Предскажите знак изменения энтропии в следующих реакциях:
а) N2(г) + 3H2(г) = 2NH3(г)
б) С(к) + Н2О(г) = СО2(г) + Н2(г)
в) 2СО(г) + О2(г) = 2СО2(г)
Решение. Известно, что энтропия газов всегда значительно больше энтропии твердых тел и жидкостей, поэтому в химических реакциях, идущих с участием газообразных веществ, энтропия реакции всегда положительна (DS0 >0), если в результате процесса возрастает число молей газообразных веществ и отрицательна (DS0 < 0), если число молей газообразных уменьшается.
Нетрудно увидеть, что в реакции (а) число молей газообразных веществ в системе уменьшается от 4 до 2, поэтому (DS0(а) < 0); в реакции (б) число молей газообразных веществ возрастает DS0(б)> 0; в реакции (в) уменьшается DS0(в)< 0.
Пример 9. Определите энтропию реакции
H2S(г) + Cl2(г) = 2HCl(г) + S(к)
 |
Решение. Поскольку энтропия – функция состояния системы, то ее изменение DrS0. в процессе химической реакции можно подсчитать, пользуясь следствием из закона Гесса:
 |
Подставив соответствующие значения энтропии для каждого из веществ, взятые из справочных данных, получаем:
Пример 10. Рассчитайте энтропийный и энтальпийный факторы протекания процесса при стандартных условиях и 298К:
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж).
Какой из факторов способствует самопроизвольному протеканию реакции в прямом направлении?
 |
Решение. Для расчета энтальпийного и энтропийного факторов воспользуемся следствием из закона Гесса:
 |
Энтальпийным фактором процесса является энтальпия реакции. Самопроизвольному протеканию процесса способствует уменьшение энтальпии системы (DН0хим.реак.). Энтропийный фактор равен произведению абсолютной температуры на энтропию реакции, т.е. Т×DS0хим.реак.. Самопроизвольному течению процесса способствует рост энтропии системы DS0 > 0.
В нашем случае энтропийный фактор равен:
Т×DS0хим.реак. = - 393,51×298 = - 117265,98 Дж, или -117,266 кДж,
величина которого не способствует самопроизвольному протеканию процесса.
Энтальпийный фактор D r Н. = –253 кДж способствует самопроизвольному протеканию процесса в прямом направлении.
Пример 11. Рассчитайте стандартную энергию Гиббса химической реакции при 298 К и установите возможность ее самопроизвольного протекания в прямом направлении.
CuSO4(к) + 2NH4OH(ж) = Cu(OH)2(ж) + (NH4)2SO4(к)
 |
Решение. Энергия Гиббса DG – термодинамическая функция состояния системы. Изменение энергии Гиббса химической реакции может быть рассчитано на основании следствия из закона Гесса:
Любая химическая реакция протекает самопроизвольно в том направлении, которое отвечает при заданных условиях (давлении и температуре) уменьшению величины G.
В данном случае DG0хим.реак.<0, следовательно возможно самопроизвольное протекание процесса в прямом направлении.
Пример 12. Установите, возможно ли при температурах 298 и 1000 К образование водяного газа по уравнению:
С(графит) + Н2О(г) = Н2(г) + СО(г),
полагая, что все газы находятся при давлении 1 атм.
Для данной реакции определите температуру начала самопроизвольного процесса при стандартных состояниях веществ.
Решение. В справочных таблицах найдем значения DfН0 и S0298 для исходных веществ и продуктов реакции.
| Вещество | DfН0, кДж/моль | S0298, Дж/(моль×К) |
| С (т) | 5,74 | |
| Н2О (г) | -241,98 | 188,9 |
| Н2 (г) | 130,7 | |
| СО (г) | -110,6 | 197,7 |
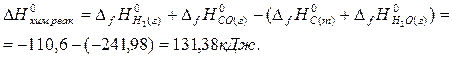 |
Рассчитаем стандартные энтальпию и энтропию реакции:
 |
Энергия Гиббса химической реакции равна DG0хим.реак. =DН0х.р.-Т×DS0х.р..
Рассчитаем DG0хим.реак. при 298 К:
DG0хим.реак. = 131,38 – 298 ×0,134 = 91,48 кДж.
Поскольку DG0хим.реак.>0, то реакция синтеза водяного газа при 298 К самопроизвольно не идет.
Приняв изменение энтальпии и энтропии реакции постоянными в температурном интервале 298–1000 К можно рассчитать изменение энергии Гиббса при 1000К:
DG0хим.реак. = 131,38 - 1000×0,134 = -2,62 кДж,
т.е. реакция взаимодействия графита с водяным паром при 1000 К становится самопроизвольной. Из реакции синтеза водяного газа видно, что если энтропия системы увеличивается, то с ростом температуры вероятность реакции тоже увеличивается.
 |
Для определения температуры, выше которой произойдет смена знака энергии Гиббса (при стандартных условиях), воспользуемся уравнением:
Следовательно, при T> 980 K и стандартном состоянии реагентов реакция может протекать самопроизвольно в прямом направлении.
Пример 13. Установите, возможно ли восстановление оксида железа(III) до свободного металла по уравнению:
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3Н2О(г)
при температуре 298 К и при начальных парциальных давлениях веществ р(Н2)= 1,5; р(Н2О) = 0,9.
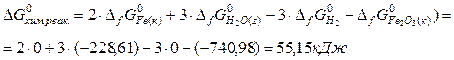 |
Решение. Изменение энергии Гиббса химической реакции рассчитаем на основании следствия из закона Гесса:
Известно, что изменение энергии Гиббса DGхим.реак. при любых начальных парциальных давлениях веществ связано с DG0х.р. уравнением, получившим название изотермы Вант-Гоффа, которое для данной реакции запишется следующим образом:
 |
отсюда
так как DGх.р. >0, то процесс невозможен.
Пример 14. Вычислить константу равновесия для реакции синтеза аммиака из стандартных энергий образования Гиббса веществ.
Решение. Запишем уравнение реакции синтеза аммиака из простых веществ6
 |
N2(г) + 3H2(г) = 2NH3(г)
Стандартное изменение энергии Гиббса для указанной реакции составляет?
Константа равновесия для Т=298 при DGх.р.=0 находится из соотношения:
 |
откуда