Приготовление рабочего раствора HCl: Рассчитайте, какой объем концентрированной HCl, I,9 (38%) необходимо взять для приготовления 300мл 0,1н раствора HCl.
Для этого:
1 Мерным цилиндром отмеряют рассчитанный объем HCl;
2 В колбу (с отметкой) наливают приблизительно половину объема дистиллированной воды, туда же наливают рассчитанный и отмеренный мерным цилиндром объем концентрированной кислоты HCl, доливают колбу дистиллированной водой до требуемого объема. Полученный раствор хорошо перемешивают.
Установка нормальности и титра рабочего раствора НСl по тетраборату натрия  .
.
Тетраборат натрия (бура) с HCl реагирует по уравнению:
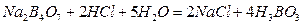
Тщательно вымытую бюретку ополаскивают небольшим количеством приготовленного раствора HCl, чтобы удалить из нее остаток воды. После этого бюретку наполняют раствором HCl. Далее пипеткой отмеряют 25мл раствора  и вливают в чистую коническую колбу. К раствору
и вливают в чистую коническую колбу. К раствору  прибавляют 2-3капли раствора метилового оранжевого. Колбу с раствором
прибавляют 2-3капли раствора метилового оранжевого. Колбу с раствором  ставят под бюретку и понемногу подливают из бюретки раствор HCl, непрерывно перемешивая жидкость. Нужно уловить момент, когда от одной капли HCl первоначально чистый желтый раствор приобретет чуть розовой оттенок. Добившись перемены окраски от одной капли соляной кислоты, делают отсчет по бюретке и записывают его. Титрование повторяют еще 1-2 раза. Результаты титрования записывают в тетрадь. Производите вычисления нормальности и титра приготовленного раствора HCl.
ставят под бюретку и понемногу подливают из бюретки раствор HCl, непрерывно перемешивая жидкость. Нужно уловить момент, когда от одной капли HCl первоначально чистый желтый раствор приобретет чуть розовой оттенок. Добившись перемены окраски от одной капли соляной кислоты, делают отсчет по бюретке и записывают его. Титрование повторяют еще 1-2 раза. Результаты титрования записывают в тетрадь. Производите вычисления нормальности и титра приготовленного раствора HCl.
Контрольные вопросы для самопроверки
1. Дайте определение «объемный анализ»?
2. Сущность метода нейтрализации.
3. Расскажите как готовят рабочий раствор соляной кислоты.
Лабораторная работа
| Тема: | Приготовление рабочего раствора титрованного раствора NaOH и установка его титра по щавелевой кислоте | ||
| Цель работы: | приготовление рабочего раствора и установление его титра. В результате выполнения работы студенты должны уметь: - титровать раствор; - готовить рабочий раствор. должны знать: -правила титрования и сущность титрования; -сущность методы нейтрализации; - формулы расчета титра и нормальности раствора. | ||
| Приборы, материалы и инструмент | штатив, бюретка, раствор гидроксида натрия, индикатор, щавелевая кислота, колба. | ||
| Порядок выполнения лабораторной работы | 1. Приготовление рабочего раствора щелочи 2. Установление нормальности и титра рабочего раствора. 3. Ответить на контрольные вопросы. 4. Подготовить отчет и приготовиться к защите лабораторной работы. | ||
Теоретическая часть
Методы нейтрализации основаны на применении реакций нейтрализации. Основным уравнением процесса нейтрализации в водных растворах является взаимодействие ионов гидроксония (или водорода) с ионами гидроксила, сопровождающееся образованием слабодиссоциированных молекул воды.
Методы нейтрализации позволяют количественно определять кислоты (с помощью титрованных растворов щелочей), основания (с помощью титрованных растворов кислот) и другие вещества, реагирующие в стехиометрических соотношениях с кислотами и основаниями в водных растворах.
Техника определения состоит в том, что к определенному количеству раствора основания (или кислоты) постепенно приливают из бюретки титрованный раствор кислоты (или основания) до наступления точки эквивалентности. Количество основания (или кислоты), содержащееся в исследуемом растворе, вычисляют по объему титрованного раствора кислоты (или основания), израсходованного на нейтрализацию определенного объема раствора анализируемого образца или навески исследуемого продукта.
Кислотность или щелочность раствора определяют c помощью индикаторов. Для проявления окраски достаточно добавить в исследуемый раствор всего лишь 1-2 капли 0,1% раствора индикатора.