Приготовление рабочего раствора NaOH.
Рассчитайте количество NaOH, требуемое для приготовления 400мл, 0,1н, NaOH.
Приготовьте 0,1н NaOH:
1)На технических весах взвешивают требуемое количества NaOH;
2)Перенести взвешенное количество NaOHтв колбу (с отметкой на определенный объем) и растворите в небольшом количестве дистиллированной воды, затем разбавьте раствор дистиллированной водой до метки и тщательно перемешайте раствор.
Установка нормальности и титра NaOH по щавелевой кислоте:
Нормальность и титр раствора щелочи можно установить по х.ч. щавелевой кислоте 
Уравнение реакций взаимодействие NaOH с 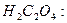

Заполните бюретку приготовленным раствором NaOH. В коническую колбу возьмите 25мл 0,1н раствора  , прибавьте к нему 8-10 капель раствора фенолфталеина и титруйте раствором NaOH, пока от одной капли последнего раствора не приобретет бледно-розовою окраску, не исчезающую в течение 0,5 мин. Титрование повторить 1-3 раза. Взяв из сходящихся цифр среднее значение объема NaOH, вычислите нормальность и титр приготовленного раствора NaOH.
, прибавьте к нему 8-10 капель раствора фенолфталеина и титруйте раствором NaOH, пока от одной капли последнего раствора не приобретет бледно-розовою окраску, не исчезающую в течение 0,5 мин. Титрование повторить 1-3 раза. Взяв из сходящихся цифр среднее значение объема NaOH, вычислите нормальность и титр приготовленного раствора NaOH.
Контрольные вопросы для самопроверки
1. На чем основана методика определений в титриметрическом анализе?
Назовите необходимые условия проведения титрования.
2. Приведите методы установления точки эквивалентности.
3.Как производится выбор индикатора?
4. Является ли молярная масса эквивалентов веществ (эквивалентная масса) постоянной величиной? От чего зависит ее значение?
Лабораторная работа
| Тема: | Установка титра рабочего раствора KMnO4. | ||
| Цель работы: | установить титр рабочего раствора KMnO4. В результате выполнения работы студенты должны уметь: - титровать раствор; - готовить рабочий раствор. должны знать: -правила титрования; -метод перманганатометрия; -область применения перманганатометрии; - формулы расчета титра и нормальности раствора. | ||
| Приборы, материалы и инструмент | штатив, бюретка, раствор перманганата калия, индикатор, щавелевая кислота, колба, серная кислота, воронка, электрическая плитка. | ||
| Порядок выполнения лабораторной работы | 1. Произвести процесс титрования. 2. Рассчитать нормальность и титр раствора. 3. Ответить на контрольные вопросы. 4. Подготовить отчет и приготовиться к защите лабораторной работы. | ||
Теоретическая часть
Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора.
Наибольшее распространение в аналитической практике получил перманганатометрический метод определения в кислых средах: восстановление МnО4- до Мn2+ проходит быстро и стехиометрично:
МnО4- + 8Н+ + 5 е- → Мn2+ + 4Н2О.
Особенностью метода является сильное влияние pH на Ео системы (МnО4- + 8Н+)/Мn2+. При титровании в сильно кислых средах чаще всего используют серную кислоту. Хлороводородную и азотную кислоты применять не следует, так как в их присутствии могут идти конкурирующие окислительно-восстановительные реакции. Восстановление перманганат-иона в щелочной среде протекает последовательно: сначала до мангант-иона МnO42-, а затем до диоксида марганца МnО2:
МnО4- + е- → МnО42-,
МnО42- + 2Н2О + 2е- → МnО2 + 4ОН-.
Количественно восстановление перманганата в щелочной среде до манганата протекает в присутствии соли бария.
Перманганатометрически в щелочной среде, как правило, определяют органические соединения: формиаты, формальдегид, муравьиную, коричную, винную, лимонную кислоты, гидразин, ацетон и др.
Признаком окончания титрования служит бледно-розовая окраска избытка титранта КМnО4 (одна капля 0,004 моль/л раствора титранта придает заметную окраску 100 мл раствора). Поэтому, если титруемый раствор бесцветен, о достижении точки эквивалентности можно судить по появлению бледно-розовой окраски избытка титранта КМnО4 при титровании прямым способом или по исчезновению окраски при обратном титровании. При анализе окрашенных растворов рекомендуется использовать индикатор ферроин.
К достоинствам перманганатометрического метода относят:
1) возможность титрования раствором КМnО4 в любой среде (кислой, нейтральной, щелочной);
2) применимость растворов перманганата калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями;
3) стехиометричность и достаточно высокую скорость большинства окислительно-восстановительных реакций с участием МnО4- при оптимально выбранных условиях;
4) возможность титрования без индикатора;
5) доступность перманганата калия.
Наряду с перечисленными достоинствами, метод перманганатометрии имеет ряд недостатков:
1) титрант КМnО4 готовят как вторичный стандарт, поскольку исходный реагент – перманганат калия – трудно получить в химически чистом состоянии;
2) реакции с участием МnО4- возможны в определенных условиях (рН, температура и т.д.);
3) титрование раствором КМnО4 не рекомендуется проводить в присутствии С1-, что затрудняет определение некоторых веществ, поскольку НС1 часто применяют для растворения минеральных объектов.
Титрованный раствор перманганата калия по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержится некоторое количество MnO2 и другие продукты разложения. Перед установлением точной концентрации раствор KMnO4 выдерживают в темной склянке в течение 7…10 дней. За это время происходит окисление восстановителей, присутствие которых в дистиллированной воде полностью исключить не удается (пыль, следы органических соединений и т.д). Для ускорения этих процессов раствор перманганата калия иногда кипятят. Необходимо учитывать, что вода обладает окислительно-восстановительными свойствами и может восстанавливать перманганат. Титр перманганата калия можно установить также по оксиду мышьяка (III) или металлическому железу. Использование для установки титра металлического железа особенно целесообразно, если в дальнейшем предполагается перманганатометрическое определение этого элемента.
В перманганатометрии применяют также растворы восстановителей – соли Fe(II), щавелевую кислоту и некоторые другие – для определения окислителей методом обратного титрования.