В присутствии некоторых лигандов стабилизируются аномально низкие степени окисления железа, например, степень окисления (0).
В 1916 на Баденскойанилиново-содовой фабрике (BASF) в Германии обнаружили забытый стальной баллон со сжатым монооксидом углерода. Когда баллон вскрыли, на дне его было около 500 мл желтой маслянистой жидкости с характерным запахом. Была установлена его химическая формула [Fe(CO)5]. При нагревании в инертной атмосфере этот карбонильный комплекс вполне устойчив (закипает при 103° С), однако легко сгорает на воздухе. Группы СО могут замещаться на другие лиганды – амины, непредельные органические соединения (например, бутадиен С4Н6) и др.:
[Fe(CO)5] + C4H6 = [Fe(C4H6)(CO)3] + 2CO
Известны комплексы железа, содержащие в качестве лиганда группу NO, например, [Fe(CN)5NO]2–, [Fe(NO)4]. Установлено, что в этих соединениях группа NO несет отрицательный заряд. Образование нитрозильного комплекса железа используется для обнаружения монооксида азота:
[Fe(H2O)6]SO4 + NO 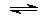 [Fe(H2O)5(NO)]SO4 + H2O
[Fe(H2O)5(NO)]SO4 + H2O
В результате этой реакции появляется характерное бурое окрашивание.
Качественной реакцией на катион железа(III) является взаимодействие с тиоцианат-ионом:
[Fe(H2O)6]3+ + nNCS– 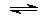 [Fe(H2O)6–n(NCS)n]3–n + nH2O
[Fe(H2O)6–n(NCS)n]3–n + nH2O
Образуется смесь тиоциантных комплексов (n = 3–6), имеющих ярко-красный цвет.
Малоустойчивые тиоцианатные комплексы железа(III) легко разрушаются в присутствии лигандов, образующих более прочные комплексы, например, фторид ионов.
Большое практическое значение имеют комплексы железа с анионами ортофосфорной кислоты, которые образуются, когда ржавчина с поверхности металлического железа удаляется водным раствором кислоты. Появившиеся в кислотной среде аквакатионы железа вступают во взаимодействие с имеющимися в растворе анионами H2PO4–,HPO42– и PO43–, в результате образуется ряд комплексов, среди которых преобладает [Fe(H2PO4)4]–. В его состав входят два бидентатных и два монодентатных лигандаH2PO4–. В меньшей степени образуются [Fe(HPO4)4]3– и [Fe(PO4)4]6–.
Особой устойчивостью отличаются цианокомплексы железа. Комплексы железа K4[Fe(CN)6]·3H2O и K3[Fe(CN)6] имеют тривиальные названия «желтая» и «красная кровяные соли». Желтую кровяную соль, видимо, обнаружили случайно в начале 18 в. Это соединение получали из животных отбросов (в том числе крови), которые нагревали вместе с карбонатом калия и железными опилками. При действии раствора желтой кровяной соли на соли железа(III) они окрашивались в синий цвет. Извлеченная из раствора краска оказалась очень яркой, относительно дешевой, неядовитой (в отличие от самой желтой кровяной соли), устойчивой к действию слабых кислот. У нее было много названий, но закрепилось одно – берлинская лазурь, наверное, потому, что первым стал использовать эту краску берлинский красильный мастер Дизбах. Способ получения берлинской лазури долго держали в секрете, но спустя несколько десятилетий химики разных стран, в том числе и первый русский ученый-естествоиспытательМихаил Васильевич Ломоносов (1711–1765), открыли тайну синтеза этого вещества. Похожую краску научились получать и другим способом. В 1822 немецкий химик Леопольд Гмелин (1788–1853) выделил красную соль K3[Fe(CN)6], окисляя хлором желтую K4[Fe(CN)6]·3H2O. Соль Гмелина реагировала с растворами солей железа(II) с образованием синего продукта, который назвали турнбулевой синью в честь одного из компаньонов фирмы «Артур и Турнбуль», вторым хозяином которой был дедушка знаменитого английского химика и физика Уильяма Рамзая (1852–1916). Сам Рамзай считал, что именно его дед, потомственный красильщик, открыл эту красивую краску. Позднее образование берлинской лазури и турнбулевой сини стали использовать для определения ионов железа в растворе: синяя окраска появляется только при действии гексацианоферрата(II) калия (желтой кровяной соли) на катион железа(III) или гексацианоферрата(III) (красной кровяной соли) на катион железа(II), но не наоборот.
Химический состав берлинской лазури и турнбулевой сини, несмотря на некоторое непостоянство, практически одинаков. Долгое время считали, что они различаются степенями окисления железа во внешней и внутренней сфере образующихся комплексных соединений. Полагали, что берлинской лазури соответствует формулаKFeIII[FeII(CN)6], а турнбулевой сини – KFeII[FeIII (CN)6], но последующие исследования показали, что берлинская лазурь и турнбулева синь – это одно и то же вещество. Удалось установить, что катионы железа(II) окружены шестью атомами углерода, а катионы железа(III) – атомами азота. Это комплексное соединение можно схематически представить в таком виде

Цианидныелиганды являются мостиковыми. А в полостях этой структуры находятся катионы калия.
Железо в степени окисления (+II) может присоединять ненасыщенные углеводороды, заполняя свои вакантные атомные орбитали p -электронами кратных связей.
На нефтеперерабатывающих заводах давно замечали образование красноватого кристаллического налета в железных трубопроводах, когда по ним при высокой температуре пропускали продукты перегонки нефти, содержащие циклопентадиен. Анализ этих кристаллов показал, что они представляют собой новое химическое соединение, которому дали название ферроцен. В состав ферроцена [Fe(C5H5)2] входят циклопентадиенил-ионы – анионы циклопентадиена, который можно рассматривать как очень слабую кислоту. Ферроцен можно получить в растворе тетерагидрофурана по реакции:
2Na(C5H5) + FeCl2 = [Fe(C5H5)2] + 2NaCl
Атом железа расположен между плоскими циклопентадианильными циклами. За сходство со знаменитым бутербродом такие комплексы стали называть «сэндвичевыми» (рис. 3).

Рис. 3. СТРОЕНИЕ ФЕРРОЦЕНА
Железо и его сплавы (чугуны и стали) – основа современной индустрии. Хотя в некоторых областях техники сплавы на основе железа несколько потеснены цветными металлами, полимерами и керамикой, они до сих пор остаются важнейшими конструкционными материалами. Из всех веществ, производимых химическими методами, железо по-прежнему находится на первом месте.
Широко используются и уникальные магнитные свойства железа. Оно – основной металл для сердечников электромагнитов и якорей электромашин. Эффективным материалом для изготовления магнитных носителей является оксид железа(III).
Каталитические свойства железа используют в синтезе аммиака.
Многие соединения железа применяются в качестве пигментов. Наиболее известными являются желто-коричневая охра (смесь гидроксидов железа с глиной) и ее разновидности – светло-коричневая сиена и коричневая умбра, красно-коричневый железный сурик (Fe2O3), желтый железооксидный пигмент (метагидроксид железа).
Ферроцен предложено использовать в качестве термостойкого теплоносителя и присадки к минеральным маслам и топливу.
В организме человека содержится около 5 г железа. Из них 57% приходится на гемоглобин крови, 7% – на миоглобин мышц, 16% связаны с тканевыми ферментами, а 20% – это запас, отложенный в печени, селезёнке, костном мозге и почках.
Гемоглобин – сложный по составу белок, содержащий и небелковую гем-группу, на долю которого приходится около 4% массы гемоглобина. Гем представляет собой комплекс железа (II) с макроциклическим лигандом – порфирином и имеет плоское строение. В этом комплексе атом железа связан с четырьмя донорными атомами азота макрокольца так, что атом железа находится в центре этого порфиринового кольца. Пятую связь атом железа образует с атомом азота имидазольной группы гистидина – аминокислотного остатка глобина (рис. 4).
Шестое координационное место атома железа используется для связывания кислорода. Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от лёгких к тканям. Гемоглобин снабжает организм кислородом и выводит из него диоксид углерода.
С оксидом углерода («угарный газ») гемоглобин способен образовать более прочные связи, чем с кислородом. Если это происходит в организме, гемоглобин теряет способность переносить кислород клеткам и выводить из организма диоксид углерода. Так происходит отравление организма оксидом углерода.
От избытка железа организм оберегает специальный фермент апоферритин. Дефицит железа в организме встречается довольно часто, в результате этого развиваются болезни крови, появляется упадок сил, общее ухудшение состояния, неестественная бледность кожи. В период формирования мозга дефицит железа вызывает нарушения в его развитии.
Суточная норма потребности человека составляет около 15 мг железа. Много железа в сливовом соке, кураге, изюме, орехах, тыквенных и подсолнечных семечках. В 10 г проросшей пшеницы содержится 1 мг железа. Черный хлеб, отруби, хлеб грубого помола также богаты железом. Следует учесть, что организмом усваивается всего лишь 10% от всего железа, получаемого с пищей. Витамины и пищевые продукты растительного происхождения способствуют усвоению железа, а в присутствии щавелевой и фитиновой кислот железо не всасывается.
При недостаточном поступлении железа в организм используют содержащие его лекарственные препараты. Для этих целей когда-то применяли даже обычные железные опилки. Из истории известно, что граф А.П.Бестужев-Рюмин (1693–1766) предложил в качестве укрепляющего и возбуждающего средства капли (они получили название «бестужевские»), представлявшие собой раствор трихлорида железа в смеси этанола и этилового эфира. Сейчас для устранения дефицита железа обычно используют порошкообразное железо в таблетках или капсулах и препараты на основе ферроцена.
Железо из руд начали выплавлять в Африке в I тысячелетии до н.э. Здесь железные руды выходят на поверхность земли. Возможно, их находили в речных наносах. В бассейне р. Замбези археологи обнаружили глиняные домны, заброшенные железорудные шахты, груды шлака. Местные племена перешли из каменного века сразу в железный, минуя бронзовый.
Со временем железо повсеместно потеснило другие металлы и стало главным материалом для изготовления инструментов, оружия, механизмов и прочих изделий. Начавшийся в те далекие времена «железный век» продолжается до сих пор. На долю железа и его сплавов приходится около 95% всей производимой в мире металлопродукции. Сейчас основную массу железа выплавляют в виде чугуна и стали.
На протяжении почти трех тысячелетий металлургия железа не претерпевала принципиальных изменений. Сначала человек научился восстанавливать железные руды нагреванием с древесным углем, получая так называемое сыродутное железо, почти не содержащее углерода (ковкое и пластичное). В 6 в. до н. э. в Китае был получен первый чугун. Он был известен и античным металлургам. Производство чугуна в Европе начало развиваться в 17 в. В нашей стране промышленное получение чугуна началось в 17 в., а при Петре I Россия по выпуску чугуна уже превзошла все страны. Древние мастера знали также способ производства литой стали путем тигельной плавки. В 19 в. были изобретены новые процессы производства стали (бессемеровский, мартеновский и томасовский), которые используются до сих пор.
Чугун получают в вертикальных печах – домнах.