КАЛИНИНГРАДСКИЙ ФИЛИАЛ
ФЕДЕРАЛЬНОГО ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ОРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ
ВЫСШЕГО ОБРАЗОВАНИЯ
«САНКТ – ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ»
Кафедра механизации сельского хозяйства
Шифр: __ 1586581 ___
Контрольная работа
по дисциплине: «Теплотехника »
Выполнил: студент
3-го курса
заочного отделения
Инженерно-технологического факультета
Урпин Алексей Валерьевич
Проверил: преподаватель
Рожков А.С.
Полесск
Задача 1.
В процессе изменения состояния 1 кг газа (воздуха) внутренняя энергия его увеличивается на Δu = 4 кДж/кг. При этом над газом совершается работа, равная l = 10 кДж/кг. Начальная температура газа t1 = 170С, конечное давление р2 = 0,7 МПа.
Определить для заданного газа показатель политропы n, начальные и конечные параметры, изменение энтропии Δ s и изменение энтальпии Δ h. Представить процесс в p – v и T - s - диаграммах. Изобразите также (без расчета) изобарный, изохорный, изотермический и адиабатный процессы, проходящие через ту же начальную точку, и дать их сравнительный анализ.
Решение:
1. Определение показателя политропы:
 ,
,
где к – показатель адиабаты, для воздуха к = 1,4.

2. Определение начальных и конечных параметров
 ,
,
 ,
,
где R – газовая постоянная, Дж/кг, для воздуха R = 287 Дж/кг.
Т1 = t1 + 273 = 17 + 273 = 290 К;
 ;
;
 ;
;
 ;
;
 .
.
3. Определение изменения энтропии
 ,
,
где с v – массовая изохорная теплоемкость, Дж/кгК.
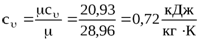 ,
,
где μсν – мольная изохорная теплоемкость, кДж/кмольК, для воздуха μсν = 20,93 кДж/кмольК;
μ – молярная масса, для воздуха μ = 28,96.
Тогда
 .
.
4. Определение изменения энтальпии
 ,
,
где ср – массовая изобарная теплоемкость, Дж/кгК.
 ,
,
где μср – мольная изохорная теплоемкость, кДж/кмольК, для воздуха μсν = 29,31 кДж/кмольК.

| 
|
| Рис. 1. Термодинамические процессы в р-ν диаграмме | Рис. 2. Термодинамические процессы в Т-s диаграмме |
Контрольный вопрос
Какова общая формулировка и математическое выражение первого закона термодинамики?
Первый закон термодинамики.
Смысл и формулировка I-го закона.
I-й закон термодинамики является выражением всеобщего закона сохранения и превращения энергии применительно к процессам, протекающим в термодинамических системах.
В самом общем виде закон сохранения материи и энергии был впервые высказан в середине 18 века русским ученым М.В. Ломоносовым. Однако лишь 100 лет спустя, после работ Майера, Гесса, Джоуля, Ленца и других ученых, была окончательно установлена однозначная связь между разными формами энергии, дано математическое обоснование сохранения и превращения энергии и этот закон получил полное признание.
Формулировка I-го закона термодинамики:
Энергия, заключенная в изолированной системе остается неизменной при всех превращениях энергии происходящих в этой системе.
(Изолированной называется система, не обменивающаяся веществом и энергией с другими телами).
Открытие и утверждение этого закона положило конец многочисленным попыткам создания вечного двигателя I-го рода.
Следствием I-го закона является принцип эквивалентности устанавливающий, что превращение различных форм энергии происходит всегда в одних и тех же количественных соотношениях.
В процессах, изучаемых технической термодинамикой, рассматривается главным образом превращение теплоты в работу.