В атоме водорода вокруг ядра (протона), несущего один элементарный заряд  движется один электрон. Ядро можно считать неподвижным, поскольку его масса в 1840 раз больше массы электрона; орбиты электрона можно (в первом приближении) полагать круговыми.
движется один электрон. Ядро можно считать неподвижным, поскольку его масса в 1840 раз больше массы электрона; орбиты электрона можно (в первом приближении) полагать круговыми.
Очевидно, что центростремительной силой, удерживающей электрон на орбите радиусом  является кулоновская сила притяжения между электроном и ядром:
является кулоновская сила притяжения между электроном и ядром:

где  масса электрона,
масса электрона,  его скорость,
его скорость, 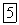 электрическая постоянная.
электрическая постоянная.
Решая уравнение (13) совместно с уравнением (11), получим после простых преобразований выражение радиуса стационарных орбит атома водорода

где квантовое число  имеет значения
имеет значения  По формуле (14) можно рассчитать радиус любой стационарной орбиты. Так, например, радиус ближайшей к ядру орбиты
По формуле (14) можно рассчитать радиус любой стационарной орбиты. Так, например, радиус ближайшей к ядру орбиты  равен
равен
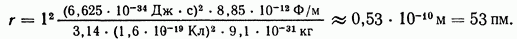
В правой части уравнения (14) все величины, кроме  являются постоянными. Следовательно, радиусы стационарных орбит относятся между собой как квадраты чисел натурального ряда, т. е. как
являются постоянными. Следовательно, радиусы стационарных орбит относятся между собой как квадраты чисел натурального ряда, т. е. как 
Орбиты водородного атома, рассчитанные по формуле (14), изображены на рис. 358; выраженные в пикометрах значения радиуса орбит равны:  большого радиуса вычерчены неполностью).
большого радиуса вычерчены неполностью).

Рис. 358
Определим теперь полную энергию  электрона в атоме. Она слагается из кинетической энергии
электрона в атоме. Она слагается из кинетической энергии  поступательного движения электрона по орбите и потенциальной энергии
поступательного движения электрона по орбите и потенциальной энергии  притяжения электрона к ядру.
притяжения электрона к ядру.
Учитывая формулу (13), получим

Что касается потенциальной энергии электрона, то она должна быть отрицательна и равна

[согласно расчету потенциальной энергии системы двух разноименных зарядов, который был выполнен в § 78, формула  Поэтому
Поэтому
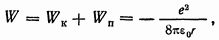
т. е. полная энергия электрона оказывается отрицательной и равной по абсолютной величине его кинетической энергии.
Подставляя в формулу (17) выражение радиуса (14), получим

По этой формуле можно рассчитать энергию электрона для любой стационарной орбиты. Так, например, для ближайшей к ядру орбиты  получим
получим
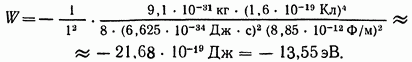
Величина полной энергии электрона, находящегося на стационарной орбите, называется уровнем энергии атома (или энергетическим уровнем). На рис. 359 схематически изображены уровни энергии водородного атома, рассчитанные по формуле (18); здесь же указаны соответствующие им значения энергии в электрон вольтах 
Согласно формуле (18), энергия атома возрастает с увеличением квантового числа  или, что то же, с увеличением радиуса электронной орбиты. Здесь надо учитывать, что энергия
или, что то же, с увеличением радиуса электронной орбиты. Здесь надо учитывать, что энергия  отрицательна; поэтому уменьшение ее абсолютной величины соответствует возрастанию энергии. Минимумом энергии
отрицательна; поэтому уменьшение ее абсолютной величины соответствует возрастанию энергии. Минимумом энергии  атом обладает при движении электрона по ближайшей к ядру орбите
атом обладает при движении электрона по ближайшей к ядру орбите  а максимумом энергии
а максимумом энергии  при движении электрона по самой дальней орбите
при движении электрона по самой дальней орбите 

Рис. 359
При переходе электрона с одной стационарной орбиты на другую (ближнюю к ядру) орбиту излучается квант энергии, равный разности энергетических уровней атома до излучения и после него. Так, например, переход электрона со второй орбиты  на первую
на первую  сопровождается излучением кванта
сопровождается излучением кванта  а переход электрона с третьей орбиты
а переход электрона с третьей орбиты  на вторую
на вторую  сопровождается излучением кванта
сопровождается излучением кванта  Этим излучениям соответствуют следующие значения частот (длин волн):
Этим излучениям соответствуют следующие значения частот (длин волн):
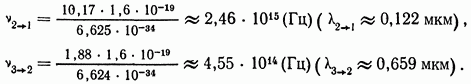
Самопроизвольный переход электрона на более далекую орбиту т. е. самопроизвольный переход атома на более высокий энергетический уровень невозможен. Для осуществления такого перехода необходимо сообщить атому определенное количество энергии извне, т. е. возбудить атом. Так, например, переход электрона о первой стационарной орбиты на вторую совершается при поглощении атомом кванта, равного  а переход электрона со второй орбиты на третью — поглощением кванта, равного
а переход электрона со второй орбиты на третью — поглощением кванта, равного 
Таким образом, атом может излучать и поглощать волны только вполне определенных частот (длин), чем и обусловлен линейчатый характер водородного спектра.
Нормальным состоянием атома является такое, при котором электрон движется по самой близкой к ядру орбите  В этом случае атом не может излучать, поскольку электрон не имеет возможности перейти
В этом случае атом не может излучать, поскольку электрон не имеет возможности перейти  этой орбиты еще ближе к ядру. Энергетический уровень
этой орбиты еще ближе к ядру. Энергетический уровень  соответствующий нормальному состоянию атома, называется нормальным уровнем; все остальные уровни называются возбужденными.
соответствующий нормальному состоянию атома, называется нормальным уровнем; все остальные уровни называются возбужденными.
Выведем теперь общую формулу частоты  излучения атома. Для этого подставим выражение энергии (18) в условие частот (12):
излучения атома. Для этого подставим выражение энергии (18) в условие частот (12):
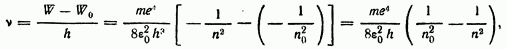
где  квантовое число и энергия, соответствующие начальному состоянию атома
квантовое число и энергия, соответствующие начальному состоянию атома  излучения),
излучения),  те же характеристики конечного состояния атома (после излучения). Величина постоянного множителя, стоящего в правой части формулы (19), оказывается равной постоянной Ридберга:
те же характеристики конечного состояния атома (после излучения). Величина постоянного множителя, стоящего в правой части формулы (19), оказывается равной постоянной Ридберга:

в чем легко убедиться, подставляя в формулу (20) численные значения универсальных постоянных  Тогда формула (19) примет вид
Тогда формула (19) примет вид

Сопоставление формулы (21) в эмпирическими сериальными формулами (8), (9) и (10) показывает, что они являются частными случаями формулы (21). В самом деле, при  формула (21) дает серию Лаймана, при
формула (21) дает серию Лаймана, при  серию Бальмера, при
серию Бальмера, при  серию Пашена.
серию Пашена.
Следовательно, спектральные линии серии Лаймана соответствуют излучению атома водорода при переходе электрона со второй, третьей, четвертой и т. д. орбит на первую; линии серии Бальмера соответствуют излучению при переходе электрона с третьей, четвертой, пятой и т. д. орбит на вторую; линии серии Пашена соответствуют излучению при переходе электрона в четвертой, пятой, шестой и т. д. орбит на третью.
Так как газ состоит из множества различно возбужденных атомов, то в нем одновременно совершаются все возможные типы переходов электрона. Поэтому в спектре излучения водорода одновременно представлены линии всех серий (при том, конечно, условии, что атомы все время возбуждаются посредством какого-либо внешнего источника энергии).
Образование спектральных серий Лаймана, Бальмера и Пашена схематически показано на рис. 358 и 359.
Отметим, что в каждой серии расстояние между спектральными линиями постепенно уменьшается в сторону коротких волн и в конце концов линии практически сливаются (см., например, рис. 357). Таким образом, каждая серия оказывается ограниченной со стороны коротких волн. Эта граница называется головой серии; ее частота определяется по формуле (21) при  что соответствует падению свободного электрона на одну из стационарных орбит водородного иона (протона).
что соответствует падению свободного электрона на одну из стационарных орбит водородного иона (протона).
Рассмотренная теория строения атома водорода применима и к водородоподобным атомам, т. е. к ионизированным атомам, содержащим только один электрон (например, к ионам  Однако в этом случае при выводе формул следует полагать заряд ядра равным не
Однако в этом случае при выводе формул следует полагать заряд ядра равным не  атомный номер элемента).
атомный номер элемента).
Применительно к водородоподобным атомам спектральная формула Бора (21) примет вид

Квантовая теория Бора сыграла важную роль в развитии физики. Количественно объяснив строение атома водорода и сложную структуру водородного спектра, она наметила правильный подход к изучению внутриатомных процессов. Правда, непосредственное использование теории Бора (в том виде, в каком она изложена ранее) для расчета спектров многоэлектронных атомов оказалось
невозможным. Понадобилось дальнейшее развитие этой теории, завершившееся созданием современной квантовой механики, количественно объясняющей все особенности строения и свойств атомов и молекул.
Тем не менее теория Бора дает возможность качественно (и притом весьма наглядно) объяснить общие черты строения многоэлектронных атомов и их спектров, в частности дает возможность обосновать закономерности расположения химических элементов в периодической системе Менделеева.
Ограниченность квантовой теории Бора обусловлена тем, что она не вполне последовательна в своих построениях: базируясь на квантовых исходных положениях (постулатах), она пользуется законами классической механики для описания движения электронов в атоме (в этом смысле ее можно было бы назвать «полуквантовой» теорией).
Между тем электрон в атоме уже не является обычной (классической) частицей, в чем легко убедиться, применив к этому электрону принцип Гейзенберга (см. § 20). Так как скорость электрона в атоме имеет порядок  то неточность в ее определении по крайней мере не должна превышать величины самой скорости, т. е. максимально допускаемая неточность
то неточность в ее определении по крайней мере не должна превышать величины самой скорости, т. е. максимально допускаемая неточность  Тогда, согласно соотношению неопределенностей (принципу Гейзенберга), неточность в определении координаты
Тогда, согласно соотношению неопределенностей (принципу Гейзенберга), неточность в определении координаты

Но  см есть размер самого атома. Следовательно, понятие местоположения электрона в атоме теряет смысл. Лишаются содержания и такие классические понятия, как траектория электрона в атоме и перемещение при его переходе с одной орбиты на другую (т. е. из одного энергетического состояния в другое). Итак, действительно, атомный электрон не является обычной частицей (в классическом смысле этого слова).
см есть размер самого атома. Следовательно, понятие местоположения электрона в атоме теряет смысл. Лишаются содержания и такие классические понятия, как траектория электрона в атоме и перемещение при его переходе с одной орбиты на другую (т. е. из одного энергетического состояния в другое). Итак, действительно, атомный электрон не является обычной частицей (в классическом смысле этого слова).
В связи с этим современная квантовая механика не устанавливает точного положения электронов в объеме атома, а рассматривает лишь вероятность нахождения электрона в том или ином месте объема. Это значит, что с точки зрения квантовой механики заряд электрона не сосредоточен в том месте, где в данный момент находится электрон, а распределен («размазан») по всему объему атома, образуя электронное облако переменной плотности. Плотность электронного облака в любой точке объема атома пропорциональна вероятности нахождения электрона в этой точке.
11. Корпускулярно-волновой дуализм. Гипотеза де Бройля. Некоторые свойства волн де Бройля. Дифракция электронов.
Корпускулярно-волновой дуализм свойств ЭМ излучения. Это означает, что природу света можно рассматривать с двух сторон: с одной стороны это волна, свойства которой проявляются в закономерностях распространения света, интерференции, дифракции, поляризации. С другой стороны свет - это поток частиц, обладающие энергией, импульсом. Корпускулярные свойства света проявляются в процессах взаимодействия света с веществом (фотоэффект, эффект Комптона).
Анализируя можно понять, что чем больше длина волны l, тем меньше энергия (из Е= hс/l), тем меньше импульс, тем труднее обнаруживаются квантовые свойства света.
Чем меньше l => больше энергия Е фотона, тем труднее обнаруживаются волновые свойства света.
Взаимосвязь между двойственными корпускулярно-волновыми свойствами света можно объяснить, если использовать статистический подход к рассмотрению закономерностей распределения света.
Например, дифракция света на щели: при прохождении света через щель происходит перераспределение фотонов в пространстве. Так как вероятность попадания фотона в различные точки экрана неодинаковая, то возникает дифракционная картина. Освещенность экрана (количество фотонов на него падающих) пропорциональна вероятности попадания фотона в эту точку. С другой стороны освещенность экрана пропорциональна квадрату амплитуды волны I~E2. Поэтому квадрат амплитуды световой волны в данной точке пространства является мерой вероятности попадания фотона в эту точку пространства.
Свойства волн де Бройля
- Пусть частица массы m движется со скоростью v. Тогда фазовая скорость волн де Бройля

 .
.
Т.к. c>v, тофазовая скорость волнде Бройля больше скорости света в вакууме (v ф может быть больше и может быть менше с, в отличие от групповой).
Групповая скорость


следовательно, групповая скорость волн де Бройля равна скорости движения частицы.
Для фотона

т.е. групповая скорость равная скорости света.
Волны де Бройля испытывают дисперсию. Подставив  в
в  получим, что vф = f (λ). Из-за наличия дисперсии волны де Бройля нельзя представить в виде волнового пакета, т.к. он мгновенно “ расплывется “ (исчезнет) за время 10-26с.
получим, что vф = f (λ). Из-за наличия дисперсии волны де Бройля нельзя представить в виде волнового пакета, т.к. он мгновенно “ расплывется “ (исчезнет) за время 10-26с.
ДИФРАКЦИЯ ЭЛЕКТРОНОВ - упругое рассеяние электронов на кристаллах или молекулах жидкостей и газов, при к-ром из первичного пучка образуются отклонённые на определ. углы дополнит. пучки электронов. Углы отклонения от нач. направления и интенсивности таких пучков определяются структурой рассеивающего объекта. Д. э., открытая в 1927 К. Дэвиссоном (С. Davisson) и Л. Джермером (L. Germer), подтвердила справедливость гипотезы Л. де Бройля (L. de Broglie, 1923) о волновых свойствах частиц.
В соответствии с квантовомеханич. представлениями движение электрона с массой т и импульсом р= mv (v - его скорость) описывается плоской монохроматич. волной, длина к-рой определяется соотношением де Вройля:

В ускоряющем электрич. поле кинетич. энергия mv 2/2 сравнительно медленно движущегося электрона с зарядом е равна приобретённой им энергии еЕ, где E - пройденная разность потенциалов. Следовательно,  . Подставляя в (1) выражение для v и численные значения констант, получим:
. Подставляя в (1) выражение для v и численные значения констант, получим:

При скоростях электрона, сопоставимых со скоростью света с, учитывая зависимость т от v ( 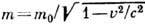 , т0 - масса покоя), получим:
, т0 - масса покоя), получим:

Гипотеза де Бройля.
Опыты по дифракции электронов и других частиц
Важным этапом в создании квантовой механики явилось установление волновых свойств микрочастиц. Идея о волновых свойствах частиц была первоначально высказана как гипотеза французским физиком Луи де Бройлем (1924). Эта гипотеза появилась благодаря следующим предпосылкам.
Гипотеза де Бройля была сформулирована до опытов, подтверждающих волновые свойства частиц. Де Бройль об этом позднее, в 1936 г. писал так: «...не можем ли мы предположить, что и электрон так же двойственен, как и свет? На первый взгляд такая идея казалась очень дерзкой. Ведь мы всегда представляли себе электрон в виде электрически заряженной материальной точки, которая подчиняется законам классической динамики. Электрон никогда не проявлял волновых свойств, таких, скажем, какие проявляет свет в явлениях интерференции и дифракции. Попытка приписать волновые свойства электрону, когда этому нет никаких экспериментальных доказательств, могла выглядеть как ненаучная фантазия».
В физике в течение многих лет господствовала теория, согласно которой свет есть электромагнитная волна. Однако после работ Планка (тепловое излучение), Эйнштейна (фотоэффект) и др. стало очевидным, что свет обладает корпускулярными свойствами.
Чтобы объяснить некоторые физические явления, необходимо рассматривать свет как поток частиц — фотонов. Корпускулярные свойства света не отвергают, а дополняют его волновые свойства. Итак, фотон — элементарная частица, движущаяся со скоростью света, обладающая волновыми свойствами и имеющая энергию е = hv, где v — частота световой волны.
Логично считать, что и другие частицы — электроны, нейтроны также обладают волновыми свойствами.
Выражение для импульса фотона рф получается из известной формулы Эйнштейна е = тс2 и соотношений е = hv и р. = тс

12.Гипотеза де Бройля. Соотношение неопределенностей Гейзенберга.
Французский ученый Луи де Бройль, осознавая существующую в природе симметрию и развивая представления о двойственной корпускулярно-волновой природе света, выдвинул гипотезу об универсальности корпускулярно-волнового дуализма. Согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики – энергия Е и импульс р, а с другой – волновые характеристики – частота n и длина волны l. Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов:
 . (1)
. (1)
Смелость гипотезы де Бройля заключалась именно в том, что соотношение (1) постулировалось не только для фотонов, но и для других микрочастиц, в частности для таких, которые обладают массой покоя. Таким образом, любой частице, обладающей импульсом, сопоставляют волновой процесс с длиной волны, определяемой по формуле де Бройля:
 . (2)
. (2)
Это соотношение справедливо для любой частицы с импульсом р.
Определим некоторые основные свойства волн де Бройля. Рассмотрим свободно движущуюся со скоростью v частицу массой m. Вычислим для нее фазовую и групповую скорости волн де Бройля. Итак, фазовая скорость:
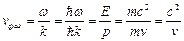 , (3)
, (3)
где  и
и  ,
,  – волновое число. Так как c>v, то фазовая скорость волн де Бройля больше скорости света в вакууме.
– волновое число. Так как c>v, то фазовая скорость волн де Бройля больше скорости света в вакууме.
Групповая скорость:  .
.
Для свободной частицы, согласно теории относительности Эйнштейна, справедливо  , тогда
, тогда
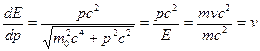 .
.
Следовательно, групповая скорость волн де Бройля равна скорости частицы.