

Механизм реакций SR
Инициирование Рост цепи
Обрыв цепи 



КЛАССИФИКАЦИЯ ПО КОНЕЧНОМУ РЕЗУЛЬТАТУ
Соответствие с конечным результатом реакции бывают:
А) реакции замещения SR SE SN
Б) реакции присоединения AR AE AN
В) реакции элиминирования E
Г) перегруппировки
Д) окисление и восстановление
Е) кислотно-основные взаимодействия
Реакции также бывают:
Региоселективные – предпочтительно протекающие по одному из нескольких реакционных центров.
Хемоселективные – предпочтительное протекание реакции по одной из родственных функциональных групп.
Стереоселективные – предпочтительное образование одного из нескольких стереоизомеров.
6. Реакции электрофильного замещения в ароматических системах имеют свои особенности. Первая особенность состоит в том, что для взаимодействия с термодинамически устойчивой ароматической системой требуются сильные электрофилы, которые, как правило, генерируются с помощью катализаторов.
Механизм реакции SE 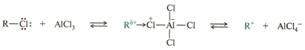

ОРИЕНТИРУЮЩЕЕ ВЛИЯНИЕ
ЗАМЕСТИТЕЛЕЙ
Если в ароматическом ядре находится какой-либо заместитель, то он обязательно оказывает влияние на распределение электронной плотности кольца. ЭД – заместители (ориентанты 1-го ряда) СН3, ОН, ОR, NН2, NR2 – облегчают замещение по сравнению с не замещенным бензолом и направляют входящую группу в орто- и пара- положение. Если ЭД заместители сильные, то не требуется катализатор эти реакции протекают в 3 стадии.
ЭА – заместители (ориентанты II-го рода) затрудняют реакции электрофильного замещения по сравнению с не замещенным бензолом. Реакции SЕ идет в более жестких условиях, входящая группа вступает в мета положение. К заместителям II рода относятся: СООН, SО3Н, СНО, галогены и др.
Реакции SЕ характерны также для гетероциклических углеводородов. Пиррол, фуран, тиофен и их производные относятся к π- избыточным системам и достаточно легко вступает в реакции SЕ. Они легко галогенируются, алкилируются, ацилируются, сульфируются, нитрируются. При выборе реагентов необходимо учитывать их не стабильность в сильнокислотной среде т.е ацидофобность.
Пиридин и другие гетероциклические системы с пиридиновым атомом азота,являются π –не достаточными системами, они гораздо труднее вступают в реакции SЕ, при этом входящий электрофил занимает β-положение по отношению к атому азота.

7. в случае несимметричных алкенов образуется, как правило один из двух возможных структурных изомеров
По правилу Марковникова – присоединение к непредельным углеводородам несимметричного строения соединений с общей формулой НХ - атом водорода присоединяется к наиболее гидрогенизированому атому углерода,если заместитель ЭД. При антимарковниковском присоединении атом водорода присоединяется к наименее гидрогенизированному, если заместитель ЭА. помеханизму электрофильного присоединения лишь при полном отсутствии кислорода в исходных реагентах и растворителе. В присутствии кислорода или даже следов пероксидов, нередко содержащихся в алкене, гидробромирование алкенов идет против правила Марковникова. реакции электрофильного присоединения
1. Гидратация. 
2. Присоединение спирта с образованием простого эфира. 
3. Присоединение хлорноватистой кислоты с образованием хлоргидринов 
4. Гидролиз нитрилов и изонитрилов. 
8. Окисление Спирты (первичные и вторичные) по сравнению с углеводородами окисляются в значительно более мягких условиях. Альдегид, образующийся при этом из первичного спирта, легко окисляется далее в карбоновую кислоту.

Особым случаем окисления является дегидрирование, когда субстрат теряет два атома водорода, что эквивалентно потере двух протонов и двух электронов (2Н+ и 2е-) или протона и гидрид-иона (Н и Н).
Тиолы при окислении образуют ряд продуктов последовательного окисления - сульфеновые, сульфиновые и сульфоновые кислоты. В этом состоит их отличие от спиртов, у которых окислению подвергается атом углерода.

Использование мягких окислителей (пероксид водорода, кислород воздуха) приводит к образованию дисульфидов. Реакция окисления тиолов и обратный ей процесс восстановления имеют важное значение в биологических системах.
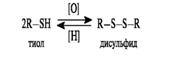
Примером дисульфида, участвующего в биохимическом окислении, может служить липоевая кислота, имеющая в составе пятичленное кольцо с дисульфидной группировкой. Восстановленная форма - дигидролипоевая кислота - представляет собой дитиол.

Амины легко окисляются; конечными продуктами при окислении первичных аминов RNH2 являются нитросоединения RNO2.На промежуточных стадиях образуются замещенный гидроксиламин RNHOH и нитрозосоединение RN=O.

9. Окисление С – Н связей (алканов и алкилов)
При полном сгорании алканов образуется СО2 и Н2О при этом выделяется тепло. Другие пути их окисления и восстановления можно представить следующими схемами: 
Окисление насыщенных углеводородов протекает в жестких условиях (хромовая смесь горячая) более мягкие окислители не действуют на них. Промежуточными продуктами окисления являются спирты, альдегиды, кетоны, кислоты.
Гидропероксиды R – О – ОН важнейшие промежуточные продукты окисления С – Н связей в мягких условиях, в частности in vivo
