Теоретическая часть
Опорные понятия темы «Основы электрохимии»
Бестоковые окислительно-восстановительные процессы:
D G 0 < 0
 Окислитель + восстановитель продукты:
Окислитель + восстановитель продукты:  .
.
 ; b B + d D → l L + m M;
; b B + d D → l L + m M;
ЭДС = ЭДС0 +  .
.
Ме 
 ;
;

Химические источники тока
(превращение химической энергии в электрическую)
Необратимые (гальванические и топливные элементы):
Zn0 + Cu2+ ® Zn2+ + Cu0; ЭДС0 =  ;
;
восст. окисл.
U = ЭДС0 – IR – Δ Е поляр.; Δ Е поляр. = Δφа + (–Δφк);
Δφэлектр. = а + b lg i.
разряд

 Обратимые (аккумуляторы): Pb + PbO2 + 2H2SO4 заряд
Обратимые (аккумуляторы): Pb + PbO2 + 2H2SO4 заряд

 2 PbSO4 +2 H2O;
2 PbSO4 +2 H2O;
разряд

 Fe + 2 Ni(OH)3 Fe(OH)2 + 2 Ni(OH)2.
Fe + 2 Ni(OH)3 Fe(OH)2 + 2 Ni(OH)2.
заряд
Электролиз (превращение электрической энергии в хими-ческую):
Катод (–) Анод (+)
 ; полож.ионы
; полож.ионы  ;
;  ; отриц.ионы
; отриц.ионы
U эл . = ЭДС0 + DE поляр. + I (Rl + R 0);

m теор = αэл · I . t; A/zF = αэл = m теорпри Q = 1Кл;
F = 96500 Кл . моль-1; F = 26,8 А . г. моль-1.
6.1.2. Окислительно-восстановительные процессы. Процесс отдачи электронов, т. е. повышения степени окисления, называется окислением; элемент, отдающий электроны – восстановитель.
Процесс присоединения электронов, т. е. понижения степени окисления, называется восстановлением; элемент, присоединяющий электроны – окислитель.
Окисление: Ме0 – z  → Мe z +. (6.1)
→ Мe z +. (6.1)
восстановитель
Восстановление: 2Н+ + 2  → Н
→ Н  . (6.2)
. (6.2)
окислитель
Важнейшие восстановители: металлы (Al, Zn, Mg); водород (Н2); углерод (С); анионы: I  , S2-; ионы металлов: Sn2+, Fe2+.
, S2-; ионы металлов: Sn2+, Fe2+.
Важнейшие окислители: галогены (F2, Cl2...); O2, S, P; анионы: Cr2O 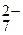 , NO
, NO  , MnO
, MnO 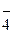 , ClO
, ClO  ; оксиды: Cl2O7, MnO2, N2O4; катионы: Fe3+, Mn4+.
; оксиды: Cl2O7, MnO2, N2O4; катионы: Fe3+, Mn4+.
В роли окислителей и восстановителей в зависимости от условий среды выступают анионы SO  , NO
, NO  , молекулы Н2О2.
, молекулы Н2О2.
Окислительно-восстановительные реакции – реакции, при которых вследствие окисления и восстановления происходит изменение степеней окисления элементов.
Возможность самопроизвольного протекания окислительно-восстановительных реакций определяется знаком энергии Гиббса.
В общем виде окислительно-восстановительную реакцию записывают следующим образом:
Ох + z  ® Red;(6.3)
® Red;(6.3)
 (6.4)
(6.4)
где  – стандартный окислительно-восстановительный потен-циал при
– стандартный окислительно-восстановительный потен-циал при  ;
;  – активности соответственно окис-лителя и восстановителя.
– активности соответственно окис-лителя и восстановителя.
Рассмотрим реакцию
2KMnO4+5NaNO2+3H2SO4 →2MnSO4+5NaNO3+K2SO4+3H2O; (6.5)
MnO 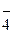 + 5
+ 5  + 8H+ → Mn2+ + 4H2O; (6.6)
+ 8H+ → Mn2+ + 4H2O; (6.6)
окисл.
NO  – 2
– 2  + H2O → NO
+ H2O → NO  + 2 H+; (6.7)
+ 2 H+; (6.7)
восст.
 , (6.8)
, (6.8)
 (6.9)
(6.9)

jокисл. > jвосст.; D G < 0.
Значит, эта реакция протекает самопроизвольно.
Рассмотренная выше реакция, протекающая в кислой среде (рН<7), при изменении рН среды сопровождается образованием совершенно иных продуктов (при рН » 7 образуется MnO2 бурого цвета, при рН > 7 MnO 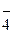 переходит в MnO
переходит в MnO  , где ион марганца шестивалентен). В ряде случаев окислительно-восстановительные реакции протекают без участия ионов и молекул воды.
, где ион марганца шестивалентен). В ряде случаев окислительно-восстановительные реакции протекают без участия ионов и молекул воды.
6.1.3. Химические источники тока. При погружении металла в раствор его собственной соли устанавливается равновесие

 Ме Ме z + + z
Ме Ме z + + z  ,
,
которое характеризуется электродным потенциалом 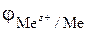 , определяющим меру окислительно-восстановительной способности металла в растворе электролита (уравнение Нернста)
, определяющим меру окислительно-восстановительной способности металла в растворе электролита (уравнение Нернста)
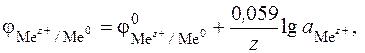 (6.10)
(6.10)
где величина 0,059 В относится к Т = 298 К.
Для измерения электродного потенциала металла, опущенного в растворы с определенной концентрацией его соли, используют электроды сравнения, электродный потенциал которых постоянен и не меняется при изменении поляризации.
В качестве электрода сравнения используют следующие (приводятся токообразующие реакции):
хлорсеребряный электрод:
AgCl + 
 Ag + Cl
Ag + Cl  ;
;
каломельный электрод:
Hg2Cl2 + 2 
 2Hg + 2Cl
2Hg + 2Cl  ;
;
ртутно-оксидный электрод:
Hg2O + 2  + H2O
+ H2O  2Hg + 2OH
2Hg + 2OH  .
.
Для хлорсеребряного электрода потенциал при 298 К равен 0,202 В (раствор KCl насыщ.).
Электродвижущая сила (ЭДС) составит:
ЭДС = φокисл – φвосст =  . (6.11)
. (6.11)
6.1.4. Электролиз. Электролизом называются окисли-тельно-восстановительные процессы, происходящие раздельно на электродах при протекании через раствор или расплав электролита электрического тока. В электролизере имеется два типа электродов: катод (-), подключенный к отрицательному полюсу источника тока, и анод (+), подключенный соответственно к поло-жительному полюсу.
Электролиз подчиняется закону Фарадея:
 , (6.12)
, (6.12)
где m – количество вещества, выделяющегося на электродах; I – ток, А; t – время, с; Эхим. – химический эквивалент; F – число Фарадея (96500 Кл.моль-1).
Отношение Эхим. /F – электрохимический эквивалент, масса вещества, выделяющегося на электродах при пропускании 1 кулона электричества.
Выход по току (ВТ) – отношение m практ. на электроде к m теор. по закону Фарадея
 . (6.13)
. (6.13)
6.1.5. Кинетика электродных процессов. При прохождении тока электродные потенциалы анода сдвигаются в область более положительных значений (анодная поляризация), а катода – в область более отрицательных значений (катодная поляризация) (рис. 6.1).
Величина сдвига потенциала от равновесного значения – перенапряжение h.
 |


Рис.6.1
Поэтому напряжение электролизера всегда больше равновесного значения электродвижущей силы и включает значение поляризации на электродах, омического падения напряжения в электролите I·r 1 и в проводниках первого рода I·r 2
U = ЭДСравн. + jполяр. + I (r 1 + r 2). (6.14)
Плотность тока i = I/S (A/см2).
Потенциал катода при плотности тока i составляет
j i к = jравн. – hк. (6.15)
Потенциал анода при плотности тока i составляет
jia = jравн. + hа . (6.16)
Причиной сдвига потенциала от равновесного значения (перенапряжение) является концентрационная (Djконц.), химическая (Djх), электрохимическая (Δjэл.х) поляризация:
Djконц.(h) = 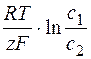 , (6.17)
, (6.17)
где с 1 – концентрация у электрода; с 2 – концентрация в глубине раствора.
Химическая поляризация обусловлена протеканием вторичных химических процессов окисления, солеобразования на электродах.
Электрохимическая поляризация Djэл.х – замедленность элек-тродной реакции окисления или восстановления.