№38 Распределение Больцмана
Поскольку  подставим это выражение в формулу
подставим это выражение в формулу 
 В показатели степени
В показатели степени 

 - Распределение Больцмана, где Wn- потенциальная энергия
- Распределение Больцмана, где Wn- потенциальная энергия
Из него следует, что при данной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Его частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
№39 Эффективный диаметр молекул. Длина свободного пробега. Сила и потенциальная энергия межмолекулярного воздействия. Релаксация. Равновесные и неравновесные состояния
Длина свободного пробега -некоторый путь L, который проходят молекулы между 2 последовательными столкновениями. Траектория движения одной молекулы представляет собой ломаную линию. Значит, расстояние между последовательными столкновениями оказывается неодинаковыми, поэтому можно говорить о средней длине свободного пробега <L>

 Эффективный диаметр - минимальное расстояние между центрами взаимодействующих молекул. Он зависит от скорости сталкивающихся молекул, т.е. от температуры газов(несколько уменьшается с ростом температуры)Не всегда параметры системы имеют определённые значения, тогда состояние системы называется неравновесным. Если систему изолировать, то через определённое время система перейдёт в равновесное состояние. Переход системы из одного состояния в другое называется процессом. Переход в равновесное состояние называется релаксацией системы. Временем релаксации называется длительность перехода системы в равновесное состояние.
Эффективный диаметр - минимальное расстояние между центрами взаимодействующих молекул. Он зависит от скорости сталкивающихся молекул, т.е. от температуры газов(несколько уменьшается с ростом температуры)Не всегда параметры системы имеют определённые значения, тогда состояние системы называется неравновесным. Если систему изолировать, то через определённое время система перейдёт в равновесное состояние. Переход системы из одного состояния в другое называется процессом. Переход в равновесное состояние называется релаксацией системы. Временем релаксации называется длительность перехода системы в равновесное состояние.
№40 Явления переноса: опытные законы диффузии, теплопроводности и внутреннего трения (вязкости).
В термодинамических неравновесных системах возникают особые необратимые процессы- явления переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. Диффузия(закон Фика) - перенос массы под действием градиента концентрации (плотности). Теплопроводность(Фурье) - перенос теплоты (внутренней энергии) под действием градиента температуры. Вязкость(Ньютон) (внутреннее трение) - перенос импульса под действием градиента скорости направленного движения
При малых отклонениях от состояния равновесия возникающие потоки переносимых
величин прямо пропорциональны соответствующим градиентам и описываются феноменологическими уравнениями следующего вида:
 = - К×grad X, где:
= - К×grad X, где:
 - плотность потока переносимой величины (теплоты - в теплопроводности, импульса
- плотность потока переносимой величины (теплоты - в теплопроводности, импульса
в вязкости, массы в диффузии), т. е. вектор, численно равный количеству величины, переносимой за единицу времени через единичную площадку, нормальную к направлению переноса;Х - величина (температура - в теплопроводности, скорость - в вязкости, плотности - в диффузии), пространственная неоднородность которой и обусловливает неравновесность состояния макросистемы; К - коэффициент пропорциональности, мера интенсивности того или иного явления переноса. Знак ” -” указывает, что импульс, теплопроводность, массы переносится в направлении убывания скорости, температуры, плотности соответственно.
№41 Степени свободы. Закон равнораспределения энергии.
Молекула идеального газа- это материальная точка, которая не имеет размеров, такая частица может двигаться только поступательно.У частиц более сложной формы приходится учитывать и вращательное движение. Молекула может быть абсолютно упругим телом, в ней могут происходить изменения взаимного расположения атомов- колебания.
Числом степеней свободы механической системы называется количество независимых величин, определяющих положение системы в пространстве.
| Вид молекулы | поступательная | вращательная | колебательная | Вид связи |
| Одноатомная молекула(идеальный газ) | --- | --- | --- | |
| Двух атомная молекула | --- | жёсткая | ||
| двухатомная | упругая | |||
| Трёхатомная(абсолютно твёрдое тело) | --- | жёсткая | ||
| Трёх и более атомная | 3N-6 | упругая |
Средняя энергия, приходящаяся на одну степень свободы (поступательную, вращательную, колебательную) одинакова и равна 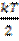 ,тогда средняя энергия молекулы, имеющая i степеней свободы равна:
,тогда средняя энергия молекулы, имеющая i степеней свободы равна:
 - закон равнораспределения энергии (для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кин.энергия=
- закон равнораспределения энергии (для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кин.энергия= 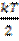 , а на каждую колебательную степень свободы- в среднем энергия, равная кТ)
, а на каждую колебательную степень свободы- в среднем энергия, равная кТ)
№42 Внутренняя энергия идеального газа. 1-ое начало термодинамики. Работа при изменении объема газа
Внутренняя энергия -энергия хаотического(теплового)движения микрочастиц системы(молекул,атомов,ядер)и энергия взаимодействия этих частиц.Значит, что к внутренней энергии не относятся кин.энергия движения системы как целого и пот. энергия системы во внешних полях, входит кинетическая энергия хаотического движения молекул и потенциальная энергия взаимодействия атомов в молекулах и молекул между собой.
 - Внутренняя энергия на один моль идеального газа
- Внутренняя энергия на один моль идеального газа
 - Внутренняя энергия газа. Работа-
- Внутренняя энергия газа. Работа- 
 -давление
-давление  Первое начало термодинамики - это частный случай закона сохранения энергии.
Первое начало термодинамики - это частный случай закона сохранения энергии. 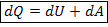
 +dA-работа над внешними силами.-dA-работа внешних тел над системой.Формулировка 1-ое начало термодинамики:
+dA-работа над внешними силами.-dA-работа внешних тел над системой.Формулировка 1-ое начало термодинамики:
1) Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
2) Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе и не зависит от способа, которым осуществляется этот переход
3)вечный двигатель 1-ого рода- периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, не возможен.(A=Q,т.е. система иногда возвращается в первоначальное состояние)
№43 Виды теплоемкостей. Теплоемкость при постоянном объеме
Теплоемкость тела — величина определяющая количество теплоты, необходимой для нагревания тела на 1К. 
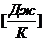
Удельная теплоемкость- теплоемкость единичной массы тела 
Молярная теплоемкость- величина, = количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К.  :Теплостойкость при постоянном объеме. V=constРассмотрим молярную теплоемкость идеального газа
:Теплостойкость при постоянном объеме. V=constРассмотрим молярную теплоемкость идеального газа  Изменение v=0, значит
Изменение v=0, значит
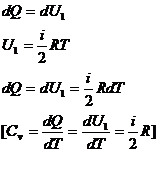
№44 Теплоемкость при постоянном давлении. Уравнение Майера. Показатель адиабаты.
Изобарный процесс— термодинамический процесс, происходящий в системе при постоянном внешнем давлении; на термодинамической диаграмме изображается изобарой.
P=const. 
Зависимость V от T найдем из уравнения Менделеева-Клапейрона



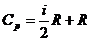 - Теплоемкость при постоянном давлении
- Теплоемкость при постоянном давлении
Из  с учетом
с учетом  .
.
 - уравнение Майера. Физический смысл уравнения- работа, совершаемая одним молем идеального газа, при его нагревании на 1К. При P=const численно равна универсальной газовой постоянной. Адиабатный процесс- процесс, при котором отсутствует теплообмен между системой и окружающей среды.
- уравнение Майера. Физический смысл уравнения- работа, совершаемая одним молем идеального газа, при его нагревании на 1К. При P=const численно равна универсальной газовой постоянной. Адиабатный процесс- процесс, при котором отсутствует теплообмен между системой и окружающей среды. 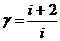 = Сп/Св - показатель адиабаты( коэффициент Пуассона)
= Сп/Св - показатель адиабаты( коэффициент Пуассона)
№45Статистическое толкование энтропии. Второе начало термодинамики и его смысл. Гипотеза о тепловой смерти Вселенной
Функция состояния, дифференциалом которой является δQ/T=dS- Энтропия(S). Энтропия замкнутой системы может либо возрастать(необратимый процесс), либо оставаться постоянной(обратимый процесс).Энтропия определяется с точностью до аддитивной постоянной. Значение постоянной не играет роли, т.к. физический смысл имеет не сама энтропия, а разность энтропий. Энтропия имеет свойство аддитивности: энтропия системы= сумме энтропий тел, входящих в систему. Второе начало термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. По Больцману: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. По Кельвину: невозможен круговой процесс, единственный результат- превращение теплоты, полученной от нагревателя, в работу. По Клаузиусу: невозможен круговой процесс, единственный результат-передача теплоты от менее нагретого тела к более нагретому. Гипотеза о тепловой смерти Вселенной: Рассматривая Вселенную как замкнутую систему и применяя к ней Второе начало термодинамики, Клаузиус свел его содержание к утверждению, что энтропия Вселенной должна достигнуть своего максимума. Это означает, что со временем все формы движения должны перейти в тепловую. Переход же теплоты от горячих тел к холодным приведет к тому, что температура всех тел сравняется, т.е. наступит полное тепловое равновесие и все процессы во Вселенной прекратятся- наступит тепловая смерть. Ошибочность вывода о тепловой смерти Вселенной заключается в том, бессмысленно применять 2 начало термодинамики к незамкнутым системам(Вселенная)
№46 Уравнение адиабаты(вывод)
Адиабатическим называется процесс, протекающий без теплообмена с окружающей средой Q=const Согласно первому началу термодинамики для идеального газа. 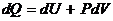 поскольку
поскольку 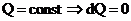 т.е. Внешняя работа совершается за счет изменения внутренней энергии системы. Перепишем уравнение
т.е. Внешняя работа совершается за счет изменения внутренней энергии системы. Перепишем уравнение  в виде:
в виде:  Продиффер. Уравнение состояния для идеального газа, получим
Продиффер. Уравнение состояния для идеального газа, получим  Исключим из последних температуру Т:
Исключим из последних температуру Т:  Разделив переменные и учитывая, что
Разделив переменные и учитывая, что  найдем
найдем  Интегрируя это ур-ние в пределах от р1 и р2, V1 и V2, а затем потенцируя, придем к
Интегрируя это ур-ние в пределах от р1 и р2, V1 и V2, а затем потенцируя, придем к  .Т.к. состояния 1 и 2 выбраны произвольно, то можно записать:
.Т.к. состояния 1 и 2 выбраны произвольно, то можно записать: 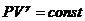 - уравнение аддиабаты.(Пуассона)
- уравнение аддиабаты.(Пуассона)
№47 обратимые и необратимые процессы. КПД тепловой машины. Цикл Карно
Обратимый процесс может быть проведен в обратном порядке через те же состояния, что и при прямом ходе. Необратимые процессы сопровождаются изменениями окружающей среды. КПД =  В. Томсон: Невозможно осуществление цикла теплового двигателя без переноса некоторого количества теплоты от источника тепла с более высокой температурой к источнику с более низкой температурой. Для превращения тепла в работу необходим, кроме источника тепла, охладитель, т.е. температурный перепад. В периодическом процессе (цикле) только часть теплоты, за счет которой осуществляется цикл, может быть превращена в работу. В любом цикле нельзя перевести все подведенное тепло в работу.
В. Томсон: Невозможно осуществление цикла теплового двигателя без переноса некоторого количества теплоты от источника тепла с более высокой температурой к источнику с более низкой температурой. Для превращения тепла в работу необходим, кроме источника тепла, охладитель, т.е. температурный перепад. В периодическом процессе (цикле) только часть теплоты, за счет которой осуществляется цикл, может быть превращена в работу. В любом цикле нельзя перевести все подведенное тепло в работу.
Карно нашел КПД идеальной тепловой машины, она должна при работе использовать только изотермические и адиабатические процессы.

 Цикл Карно́ — идеальный цикл тепловой машины.. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадает соответственно с максимальной и минимальной температурами цикла Карно.
Цикл Карно́ — идеальный цикл тепловой машины.. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадает соответственно с максимальной и минимальной температурами цикла Карно.
Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этом энтропия аддиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
.
№50 Уравнение Ван-дер-Ваальса. Модель реального газа Ван-дер-Ваальса
Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не V_m,а V_m-b, где b- объем занимаемый самими молекулами. Объем b =учетверенному собственному объему молекул. Действие сил притяжения газа приводит к появлению внутреннего давления. ( p=a/V_m^2 ) a –постоянная Ван-дер-Ваальса, V_m-молярный объем. Вводя эти поправки, Уравнение Ван-дер-Ваальса для 1 моля газа (p+a/V_m^2)*(V_m-b)=RT. Для произвольного количества вещества (n=m/M) Уравнение Ван-дер-Ваальса(p+(n^2*a)/(V^2))*(V/n-b)=RT
№51Внутренняя энергия реального газа
Внутренняя энергия реального газа складывается из кин. энергии теплового движения его молекул(U=C_v*T) и пот. энергии межмолекулярного взаимодействия. Пот. энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ:  . Работа идет на увеличение пот. энергии системы
. Работа идет на увеличение пот. энергии системы 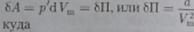 откуда:
откуда:  . Знак”-“ означает, что молекулярные силы, создающие внутреннее давление-силы притяжения. Внутренняя энергия 1 моль реального газа:
. Знак”-“ означает, что молекулярные силы, создающие внутреннее давление-силы притяжения. Внутренняя энергия 1 моль реального газа:  растет с повышением температуры и увеличением объема. При адиабатном расширении без совершения внешней работы внутренняя энергия газа не изменяется.
растет с повышением температуры и увеличением объема. При адиабатном расширении без совершения внешней работы внутренняя энергия газа не изменяется.
№52 Эффект Джоуля-Томсона
В теплоизолированной трубке с пористой перегородкой есть 2 поршня, которые могут перемещаться без трения. Пусть сначала слева от перегородки газ под поршнем1 находится под давлением р1, занимает объем V1 при температуре Т1, а справа газ отсутствует(поршень2 придвинут к перегородке). После прохождения газа через пористую перегородку в правой части газ получился р2,V2,Т2. Т.к. расширение газа происходит без теполообмена с окр. средой(адиабатно), то основании 1 начала термодинамики: 
Внешняя работа, совершаемая газом, состоит из положительной работы при движении поршня2( ) и отрицательной при движении поршня1(
) и отрицательной при движении поршня1( ).Подставляя выражения для работ,получим
).Подставляя выражения для работ,получим  . Таким образом, в опыте Джоуля-Томсона сохраняется величина
. Таким образом, в опыте Джоуля-Томсона сохраняется величина 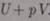 .Она является функцией состояния- энтальпия. Изменение температуры реального газа в результате его адиабатного расширения(адиабатного дросселирования)- медленного прохождения газа под действием перепада давления сквозь дроссель (пористая перегородка)- Эффект Джоуля-Томсона. Он- положителен, если газ в процессе дросселирования охлаждается, отрицательным - если газ нагревается. Температура, при которой происходит изменение знака эффекта- температура Инверсии.
.Она является функцией состояния- энтальпия. Изменение температуры реального газа в результате его адиабатного расширения(адиабатного дросселирования)- медленного прохождения газа под действием перепада давления сквозь дроссель (пористая перегородка)- Эффект Джоуля-Томсона. Он- положителен, если газ в процессе дросселирования охлаждается, отрицательным - если газ нагревается. Температура, при которой происходит изменение знака эффекта- температура Инверсии.  Кривая, определяемая уравнением- кривая инверсии. Область выше этой кривой- отрицательный эффект, ниже- положительный.
Кривая, определяемая уравнением- кривая инверсии. Область выше этой кривой- отрицательный эффект, ниже- положительный. 