ВОПРОС№1. Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная частьзвёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
[править] Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место послекислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
[править]Получение
Основная статья: Производство водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре:
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
[править] В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
H2O + C ⇄ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇄ CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇄ 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
[править] В лаборатории
1. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
2. Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
3. Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
4. Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5. С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
Физические свойства
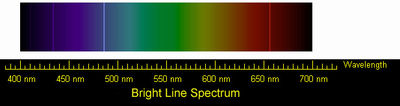

Спектр излучения водорода


Эмиссионный спектр водорода
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.


Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группаP6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и пара водорода. В молекуле ортоводорода o -H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p -H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o -H2 и p -H2 при заданной температуре называется равновесный водород e -H2.


Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированныйпараводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Химические свойства


Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
[править] Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Отсюда можно взять примеры..
ВОПРОС№2 Галогены. Фтор.
Строение молекулы 
С точки зрения теории молекулярныхорбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающихорбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.У фтора валентность=1.
У остальных галогенов будет такой же рисунок только электронов будет больше и валентность и порядок связи тоже будет больше.
На соседнем с внешним уровне у фтора два электрона, у
хлора – восемь и у брома, йода и астата – восемнадцать электро-
нов. Последние три элемента – полные электронные аналоги.. Галогены – наиболее типичные не-
металлы, причем фтор обладает наибольшим значением элек-
троотрицательности. В ряду F → Cl → Br → I → Atувеличива-
ются радиусы атомов, уменьшается электроотрицательность
элементов, ослабевают неметаллические свойства и окислитель-
ная способность галогенов.
Стандартный
электродный потенциал
F=+2,87CL=+1,36Br= +1,07 I=+0,54
Вопрос№3. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группыгалогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резкимзапахом, напоминающим озон или хлор. Очень ядовит.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[8].
[править]Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
2CoF3 → 2CoF2 + F2
MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[9].
| Внешний вид простого вещества |
 почти бесцветный газ (в толстых слоях — зеленовато-жёлтый)[1] почти бесцветный газ (в толстых слоях — зеленовато-жёлтый)[1]
|
Состав:F= 9 електронов, 9 протонов и 1 нейтрон.
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты. Фтор окисляет воду,а другие галогены растворяется в ней. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I− уменьшается.
Вопрос№4.на половину.Изменяется сила кислот так как у хлора меняется степень окисления от +1 до +7,что повышает силу кислот в этом ряду. Хлорноватистая кислота — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Хлористая кислота — HClO2, средняя одноосновная кислота. Хлорноватая кислота — HClO3, сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоде довольно устойчива; в более концентрированных растворах распадается:
8HClO3 = 4HClO4 + 3O2 + 2Cl2 + 2H2O
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK = ~ -10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления.
Вопрос №5. Фторид хлора(I) (монофторид хлора, фтористый хлор) — ClF, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным разражающим запахом. Конденсируется при охлаждении до −100 °C в жидкость бледно-жёлтого цвета. Многие свойства сходны со свойствами фтора и хлора.
Химические свойства
Химически очень активное вещество по своей активности в некоторых реакциях превосходит фтор. Хороший фторирующий агент. За счет того, что атом хлора находится в степени окисления+1 проявляет сильные окислительные свойства.
§ Реагирует с водой с образованием свободных кислорода и хлора:
4ClF + 2H2O → 2Cl2 + O2 + 4HF
§ При нагревании очень активно реагирует с водородом. При этом образуются фтороводород и хлороводород:
ClF + H2 → HCl + HF
§ ClF реагирует с хлоридами металлов с образованием фторидов и хлора:
NaCl + ClF → NaF + Cl2
§ При взаимодействии с простыми веществами образуются фториды:
Br2 + 6ClF → 2BrF3 + 3Cl2
Si + 4ClF → 2SiF4 + 2Cl2
W + 6ClF → WF6 + 3Cl2
§ С монооксидом углерода проходит реакция хлорфторирования:
CO + ClF → COClF
§ С фторидами Cs, Rb и K под высоким давлением образуются бесцветные устойчивые до 200 °C соли:
CsF + ClF → CsClF2
§ Необычное полимерное соединение фиолетового цвета состава (F3ClO2)n было получено при взаимодействии ClF и O2F2:
nClF + nO2F2 → (F3ClO2)n 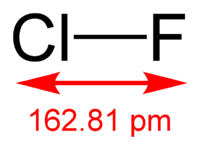
Фторид хлора(III) (трифторид хлора, трёхфтористый хлор) — ClF3, соединение хлора сфтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до +12 °C (или при увеличении давления) в жидкость бледно-зёленого цвета.
| Фторид хлора(III) |

|
Химические свойства
Сильный окислитель. Бурно реагирует (иногда со взрывом) с большинством органических и неорганических соединений, в частности с водой. Способен воспламенять стекло, поэтому для работы с ним используют посуду из фторопласта или монель-металла.
Фторид хлора(V) (пентафторид хлора) — ClF5, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −13 °C (или при увеличении давления) в бесцветную жидкость.
Химические свойства
Сильный окислитель. Реагирует с водой.
§ При нагревании разлагается в ClF3 и F2:
ClF5 → ClF3 + F2.
§ Под действием ультрафиолетового излучения, вступает во взаимодействие с PtF6, при этом образуется смесь ClF6PtF6 и ClF4PtF6[1]:
2PtF6 + 2ClF5 → ClF6PtF6 + ClF4PtF6.
Оксид хлора (I), гемоксид хлора, ангидрид хлорноватистой кислоты — соединение хлора встепени окисления +1 с кислородом.
| Оксид хлора(I) |

|
Свойства
Представляет собой буровато-желтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. Самопроизвольно медленно разлагается. При больших концентрациях взрывоопасен. Плотность при нормальных условиях 3,22 кг/м³. Растворяется в четырёххлористом углероде. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:
H2O + Cl2O ↔ 2HClO.
Хлорноватистая кислота — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
| Хлорноватистая кислота |

|
Свойства
В водных растворах хлорноватистая кислота частично распадается на протон и гипохлорит-анион ClO−:

Неустойчива, постепенно разлагается даже в разбавленных водных растворах.
Хлорноватистая кислота и её соли — гипохлориты — сильные окислители. Реагирует с соляной кислотой HCl, образуя молекулярный хлор:
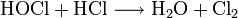
Кристаллогидрат  выдерживает длительное хранение;
выдерживает длительное хранение;  при 70 °C разлагается со взрывом, а KClO известен только в виде водных растворов. Ca (ClO)2 в сухом виде вполне устойчив, но в присутствии H2O и CO2 разлагается. Более стоек Mg(ClO)2.
при 70 °C разлагается со взрывом, а KClO известен только в виде водных растворов. Ca (ClO)2 в сухом виде вполне устойчив, но в присутствии H2O и CO2 разлагается. Более стоек Mg(ClO)2.
Хло́рная и́звесть Ca(Cl)OCl — смесь гипохлорита, хлорида и гидроксида кальция. Относится к так называемым смешанным солям.
Свойства
На воздухе хлорная известь медленно разлагается по схеме:
 .
.
 , термическое разложение
, термическое разложение


Белильная известь обладает антисептическим и дезинфицирующим действием.
Вопрос№6. Кислород. Химические свойства: до завершения энергетического уровня кислороду нужно 2 электрона, которые он принимает проявляя степень окисления -2, но в соединении со фтором кислород ОF2 -2 и О2F2 -1. Благодаря химической активности кислород взаимодействует почти со всеми простыми веществами. С металлами образует оксиды и пероксиды: кислород является окислителем.

Кислород не реагирует только с платиной. При повышенных и высоких температурах реагирует со многими неметаллами:


Непосредственно кислород не взаимодействует с галогенами. Кислород реагирует со многими сложными веществами:

Кислороду характерны реакции горения:

В кислороде горят многие органические вещества:

При окислении кислородом уксусного альдегида получают уксусную кислоту:

О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха, озон же пахуч, имеет бледно-фиолетовый цвет, он более бактерициден.
СЕРА.Существует несколько известных аллотропных модификаций серы:
1) циклическая форма;
2) моноклинная форма;
3) кристаллическая ромбическая форма.
Сера не растворима в воде, но растворима в органических растворителя х. Является диэлектриком.
Химические свойства:
1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S;(сера-окислитель)
2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3;;(сера-окислитель)
И с неметаллами сера-окислитель: 2S+C=SC2
3) при сжигании серы в струе кислорода образуется сернистый газ или сернистый ангидрид SO2: S + O2 = SO2;(сера-восстановитель)
4) чистая сера способна проявлять восстановительные свойства: S + 2HNO3 = H2SO4 + 2NO.
Сера используется в большом количестве в народном хозяйстве. Серу используют для получения резины – при помощи серы происходит ее затвердевание (вулканизация).
Каучук с высоким содержанием серы называется эбонит, являющийся качественным электрическим изолятором. Для уничтожения некоторых сельскохозяйственных вредителей серу применяют в виде серного цвета. Серу используют для приготовления спичек, синей краски (ультрамарина), сероуглерода, серной кислоты.
Вопрос№7.Простое вещество кислород (CAS-номер: 7782-44-7) принормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Кислотные свойства кислорода:


O2+2Mg=2MgO
Основные оксиды
К2О,ВаО.
Амфотерные
ZnO, Al2O3.
Кислотные
SO3,N2O5.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H2SO4 = CuSO4 + H2O
Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
CaO + H2O = Ca(OH) 2
Большинство основных оксидов с водой не взаимодействуют, но им также соответствуют основания, которые можно получить косвенным путем.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na2O + SO3 = Na2SO4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B2O3; N2O5).
Многие кислотные оксиды соединяются с водой, образуя кислоты:
N2O3 + H2O = 2HNO2
SO3 + H2O = H2SO4
Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.
Кислотные оксиды реагируют с основными оксидами с образованием соли:
CO2 + CaO = CaCO3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + Ba(ОН)2= BaCO3 + H2O
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например - Al2O3, Cr2O3, MnO2; Fe2O3 ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Так как далеко не все амфотерные оксиды расворимы в воде, то доказать амфотерность таких оксидов заметно сложнее. Например, оксид алюминия (III) в реакции сплавления его с дисульфатом калия проявляет основные свойства а при сплавлении с гидроксидами кислотные:
Al2O3 + 3K2S2O7 = 3K2SO4 + A12(SO4)3
Al2O3 + 2KOH = 2KAlO2 + H2O
У различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) - Fe2O3 - обладает преимущественно основными свойствами.
Вопрос№8 Сероводоро́д (серни́стыйводоро́д, сульфид водорода) — бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5 — 45 % сероводорода.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканических газов. Образуется при гниении белков. Сероводород используют в лечебных целях, например, в сероводородных ваннах.[1]Свойства
Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — Sи H2). Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34×10−29Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочныхводородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота.
.С водородом сера в обычных условиях не соединяется. Лишь при нагревании протекает обратимая реакция:
|
Основной недостаток теории С. Аррениуса, на основе которой были даны приведенные определения кислот, оснований и солей, состоит в том, что эти определения подходили только для водных растворов. Некоторые свойства кислот и оснований теория С. Аррениуса не могла объяснить, поэтому в 1923 г. И. Н. Бренстед заложил основы новой теории, по которой кислоты и основания характеризуются вне зависимости от растворителя. По этой теории к кислотам относят вещества, отщепляющие протон р, т. е. доноры протона. К. основаниям относят вещества, присоединяющие протон, т. е. акцепторы протона. Кислотами и основаниями могут быть в данном случае электронейтральные молекулы и ионы с различными зарядами:
Кислоты Основания СН3СООН.± р+СНзСОО' NH4.±p+NH3 Н2Сб3 HCOJ HSO4 *tp+SOl~ н3о+ +±р+НгО
н2о.±р+он-
Все кислоты и основания в классическом понимании включаются в этот круг и по теории И. Н. Бренстеда. Но этот круг расширяется протонной теорией. Например, кислотой будет ион NH^ в воде, если он отдаст протон, а основанием HSO3, если он примет протонHSOJ+^HjSO,
Существенное преимущество новой теории состоит в том, что в ней нет внутренних противоречий. Понятие «кислота» и «основание» не закреплялись за конкретными веществами. Одно и то же вещество может быть как кислотой, так и основанием в зависимости от условий.
Теория Бренстеда хорошо объясняет подтверждаемый экспериментом, факт широкой распространенности амфотерных свойств. В частности, получение таких соединений, как перхлорат нитрония [НгЖ)зз+ ClOi", при образовании которого азотная кислота выполняет функцию оснований и входит в состав катиона. Но теория Бренстеда не может объяснить наличие кислотных и основных свойств у соединений, не содержащих водорода (СО2, SO2, СаО, ВаО).
§14. АМФОТЕРНОСТЬ
Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные н основные свойства.
По теории Бренстеда, амфотерные свойства имеют вещества, которые в реакциях, протекающих в растворах, присоединяют
или отдают протоны. Самое распространенное амфотерное соединение—вода, так как она может как присоединять, так и терять протон:
н2о+р?± н3о+
Н20-р?± ОгГ
По теории Аррениуса амфотерные соединения реагируют как с кислотами, так и с основаниями. Это объясняется их способностью одинаково легко диссоциировать по типу кислоты и по типу основания:
Zn(OH)2 Zn2 + + 20Н " H2ZnC>2?± 2H++ZnOj
Амфотерные свойства проявляют прежде всего гидроксиды металлов, которые имеют промежуточную электроотрицательность. Она характерна для гидроксидов цинка, алюминия, хрома (III), мышьяка (III), сурьмы (III). По классическим представлениям взаимодействие гидроксида цинка с кислотой и основанием можно выразить уравнениями:
Zn (ОН)2+2НС1=ZnCl2+2Н20
H2ZnOz+2NaOH= Na2Zn02 +2Н20 цинка г натрия
Цинкат-ионы в водном растворе практически не существуют, а поэтому по теории Бренстеда эти уравнения имеют следующий вид:
[Zn(H20)2](OH)2 + 2H30+ *± [Zn(H20)4]2+ +2Н20 [Zn(H20)2](OH)2+20H- [Zn(OH)4]2- +2Н20
Анионы, содержащие цинк, можно представить двояко: ZnOf~ или [Zn(OH).*]2~. Эти формулы различаются только числом сольватирующих молекул воды. Установить это число в растворе вообще невозможно. Из исследований веществ в твердом состоянии вытекает, что структуру анионов правильнее отражают формулы, которые учитывают максимальную гидратацию, т. е. следует писать [Zn(OH)4.]2~\ а не ЪлО\~, т. е. уравнения, по Бренстеду, более точно описывают реакцию.
Понятие кислотности, амфотерности и основности распространяют и на сульфиды металлов. К кислотным сульфидам относят те, которые растворяются в основных растворах с образованием тиоаниона. Основные сульфиды растворяются в кислотах с образованием ионов металла. Амфотерные сульфиды проявляют оба эти- свойства в зависимости от среды, в которой протекает реакция. Например, в водном растворе амфотерные свойства проявляет сульфид сурьмы (III), что можно представить уравнениями:
Получение
§ Взаимодействие разбавленных кислот на сульфиды:

Вопрос№9.
 1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
SO3 + H2O → H2SO4.
| Серная кислота |

|

|

|
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
5SO3 + 2P→ P2O5 + 5SO2
3SO3 + H2S → 4SO2 + H2O
2SO3 + 2KI → SO2 + I2 + K2SO4.
Физиологическое действие

SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
§ ПДК(предельно допустимая концентрация) максимально-разового воздействия — 0,5 мг/м³