При окислении метана водяным паром протекают следующие химические реакции:
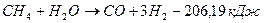 ;
;
 .
.
Константа равновесия реакции конверсии метана водяным паром, записанная через парциальные давления компонентов выглядит следующим образом:
 .
.
Константу равновесия реакции конверсии метана водяным паром в зависимости от температуры можно определить с использованием эмпирического уравнения:
 .
.
В таблице 3 представлены значения степени превращения метана и СО и состава конвертированного газа от температуры (при Р равном 0,1 МПа, соотношении пар/газ равном 2).
Таблица 3
Равновесный состав конвертированного газа при конверсии метана водяным паром
| Т, К | Степень превращения, % | Состав равновесной парогазовой смеси, об. % | |||||
| CH4 | CO | CH4 | CO | CO2 | H2 | H2O | |
| 38,80 | 29,98 | 16,21 | 2,36 | 7,94 | 38,74 | 34,75 | |
| 75,90 | 32,90 | 5,33 | 9,51 | 7,28 | 57,71 | 20,17 | |
| 94,98 | 24,84 | 1,02 | 14,32 | 5,07 | 63,23 | 16,36 | |
| 99,50 | 19,24 | 0,10 | 16,08 | 3,86 | 63,68 | 16,28 |
Как видно из таблицы 3 осуществление конверсии метана и оксида углерода (II) водяным паром в одну ступень с высоким выходом водорода в одну ступень невозможно. Поэтому конверсию СО водяным паром проводят на другой стадии.
Влияние давления на равновесие реакции.
Согласно принципу Ле-Шателье, с повышением давления равновесие реакции конверсии метана водяным паром смещается влево и остаточное содержание метана в конвертированном газе возрастает. Низкое давление термодинамически целесообразно для данного процесса, но это условие экономически и технологически невыгодно для процесса синтеза аммиака в целом, который осуществляют при высоком давлении.
Влияние концентрации исходных реагентов.
Равновесие реакции можно сместить за счет изменения концентрации реагирующих веществ.
С технологической и экономической точки зрения целесообразно использовать избыток водяного пара, так как в этих условиях:
- степень конверсии возрастает;
- предотвращается крекинг метана с образованием элементарного углерода.
CH4 = C + 2H2
Исследованиями установлено, что в процессе каталитической конверсии при температуре 600-8000С образуется аморфная сажа, а при 1100-12000С выделяется углерод в виде плотного графита, который проникая в поры катализатора, резко снижает его активность.
Таким образом, с точки зрения термодинамики данную реакция целесообразно проводить при повышенном давлении, избытке водяного пара и повышенной температуре.
Кинетический анализ процесса.
В промышленных условиях конверсию метана можно проводить в гомогенных и гетерогенных условиях.
С достаточной скоростью реакция конверсии метана в гомогенных условиях протекает при температуре 1300-1400°С.
При этих условиях:
- процесс сопровождается значительным сажевыделением за счет крекинга метана;
- увеличивается энергоемкость производства.
В условиях действующего производства процесс конверсии метана осуществляют в присутствии катализаторов.
В азотной промышленности России для паровой конверсии метана используют никелевые катализаторы, которые должны обладать:
- высокой активностью;
- стабильностью;
- механической и термической прочностью.
Этим требованиям отвечают катализаторы следующих марок: ГИАП-3-6н, ГИАП-8; ГИАП-16; КСН-2.
Содержание никеля в катализаторах различных марок колеблется от 3 до 40%.
Катализаторы приготавливают, используя два основных способа:
- по первому способу - соединения никеля и промоторов (активирующие и стабилизирующие добавки) смешивают с порошкообразным носителем, полученную однородную массу формуют экструзией или таблетированием в полусухом или сухом состоянии;
- по второму способу - каталитически активные вещества наносят на сформованный или прокаленный инертный носитель путем 2,3,4-х - кратного пропитывания его растворами солей никеля и промоторов.
В качестве носителей применяют чистый оксид алюминия с добавками оксидов других металлов. Готовый катализатор прокаливают при температуре 400°С для перевода солей никеля в оксиды.
Активность катализатора конверсии метана (первичного риформинга) характеризуется остаточным содержанием метана в конвертированном газе при заданных условиях. При температуре 750-830°С активность никелевого катализатора достаточно велика. При объемных скоростях 4000 ч-1 на гранулах промышленного катализатора достигается степень превращения углеводородов, близкая к расчетной.
Характеристика катализатора ГИАП - 16
Состав катализатора (масс.%): 24-26 NiO; 55-59 Al2O3; 14-16 CaO; 1 MgO; 0,8-1,2 BaO.
Удельная поверхность - 64м2/г, выпускается в виде колец размером 15х12х7мм.
Марки катализаторов других стран: США – С-11-2; С-11-5; Англия – 57-1; 54-1.
Механизм конверсии.
Согласно литературным данным, на механизм конверсии метана водяным паром единой точки зрения не существует. Для объяснения механизма используют различные теории.
1. Радикальный механизм: (авторы Жидков, Шарифов):
CH4 = CH*3 + H* (а)
CH*3+ H2O = CO +3/2H2 (б)
Авторы считают, что лимитирующей стадией процесса паровой конверсии является вторая. Определяющим является наличие в газовой фазе метильного радикала CH*3.
Пары воды, водород и монооксид углерода не оказывают влияния на процесс конверсии. С учетом данного механизма, авторы предложили для расчета скорости реакции следующее кинетическое уравнение:
rсн4 = K∙CH*3 = K∙P0,5CH4
Применительно к условиям действующего производства, приведенное кинетическое уравнение имеет следующее выражение:
rHz = kP0,75 CH4
2. Окислительно-восстановительный механизм (авторы: Темкин и Кулькова).
К* + H2O = K*-O + H2 (1)
K*-O + CH4 = K* + CO + 2H2 (2)
Скорость процесса конверсии можно рассчитать, используя кинетическое уравнение:
r = k PCH4 /P2H2
3. Радикальный механизм конверсии метана.
CH4 + Z = ZCH2 + H2
ZCH2 + H2O = ZCHOH +H2
ZCHOH = ZCO + H2
ZCO = Z + CO
Z + H2O = ZO + H2
ZO + CO = Z + CO2,
где Z – активный центр поверхности катализатора.
Процесс конверсии метана водяным паром, с учетом предложенного механизма, лимитируется образованием промежуточного комплекса.
Для практических расчетов скорости конверсии метана водяным паром, применительно к гранулам промышленного катализатора ГИАП-16, используют следующее кинетическое уравнение:


Из анализа кинетического уравнения следует, что скорость паровой конверсии метана увеличивается с повышением температуры и уменьшением давления.
Обоснование оптимальных параметров процесса паровой конверсии метана.
1.Температура.
С повышением температуры скорость реакции возрастает, а значит остаточное содержание метана в конвертированном газе уменьшается. Предел повышения температуры ограничивается температурным интервалом работы катализатора и для катализатора ГИАП-16 она не должна превышать 850°С.
2. Давление.
Согласно данным теоретического анализа, с повышением давления скорость реакции снижается. При проведении процесса конверсии под давлением высокая степень конверсии может быть получена при увеличении температуры. Давление на стадии паровой конверсии поддерживают в пределах 20-40атм.
3. Соотношение исходных реагентов.
Оптимальное соотношение пар/газ должно находиться в пределах 3,7-4,2. Это соотношение обеспечивает высокую скорость конверсии и исключает процесс образования элементарного углерода.